微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6mol/L NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片用水冲洗、烘干后称量,得质量为m2。下列说法正确的是 [???? ]
A.设锌镀层厚度为h,锌的密度为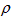 ,则
,则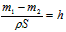
B.锌电极上发生还原反应
C.锌和石墨形成原电池,外电路中电流从锌流向石墨
D.当石墨不再产生气泡时,应立即取出铁皮
参考答案:D
本题解析:
本题难度:一般
2、填空题 (15分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
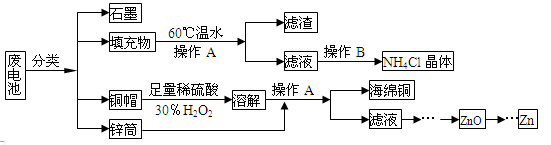
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。
铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,
试写出该反应的化学方程式: 。
参考答案:(15分)
(1)加快溶解速率(2分)
(2)过
本题解析:
试题分析:(1)升高温度,溶解速度加快,所以填充物用60℃温水溶解,目的是:加快溶解速率。
(2)经过操作A得到滤渣和滤液,所以操作A为过滤。
(3)H2O2具有强氧化性,在H2SO4条件下可把Cu氧化为CuSO4,所以化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;H2O2受热分解生成H2O和O2,所以可用加热的方法除去溶液中过量的H2O2。
(4)根据电池总反应,Zn在负极上失电子生成Zn(OH)2,电极方程式为:Zn+2OH--2e-=Zn(OH)2。
(5)①根据化学方程式,当1 mol MnO2参加反应时,同时有2molMnO(OH)反应,Mn元素均转为Mn2+,共有4mol电子发生转移。
②MnO(OH)与浓盐酸的反应可仿照MnO2与浓盐酸的反应,MnO(OH)把HCl氧化为Cl2,配平可得化学方程式:2MnO(OH)+6HCl(浓) 2MnCl2+Cl2↑+4H2O。
2MnCl2+Cl2↑+4H2O。
考点:本题考查化学流程的分析、基本操作、原电池原理、氧化还原反应原理、化学方程式的书写。
本题难度:困难
3、选择题 图为铜锌原电池示意图,下列说法正确的是( )
A.锌片发生还原反应
B.烧杯中溶液逐渐呈蓝色
C.电子由锌片通过导线流向铜片
D.该装置能将电能转变为化学能
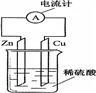
参考答案:A、因Zn作负极,则Zn失去电子发生氧化反应,故A错误;
本题解析:
本题难度:简单
4、选择题 原电池是将化学能转化为电能的装置,但其构成具有一定的条件,这些条件是( )
①电极(负极与正极:金属活动性不同)?②电解质溶液??③闭合回路??④灯泡.
A.①②③④
B.①②③
C.①②④
D.②③④
参考答案:原电池是将化学能转化为电能的装置,
则对于常温下自动发
本题解析:
本题难度:一般
5、选择题 将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱
D.产生气泡的速率甲比乙慢
参考答案:C
本题解析:
试题分析:A、甲烧杯可以形成原电池,Cu作正极,有气泡产生,错误;B、乙不是闭合回路,不能形成原电池,不存在正负极,错误;C、2个装置中的反应的实质都是Zn与氢离子反应生成氢气,所以酸性均减弱,正确;D、甲发生的是电化学反应,乙发生的是化学反应,电化学反应速率比化学反应速率快,错误,答案选C。
本题难度:一般