微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知Ag2SO4的KW为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是(??)
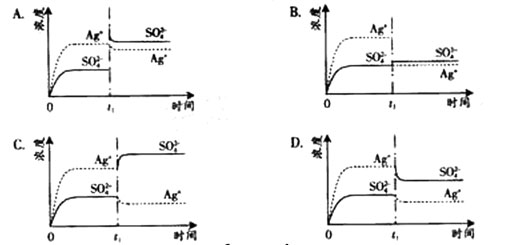
参考答案:B
本题解析:Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.034mol/L,所以c(SO42-)=0.017mol/L;当加入100ml 0.020mol/LNa2SO4溶液后,c(SO42-)=0.0185mol/L,c(Ag+)=0.017mol/L(此时Q<Ksp)。由计算可知选B。
本题难度:一般
2、选择题 下列指定溶液中的各组离子能够大量共存的是( )
A.pH=11的溶液中:S2-、K+、
CO
2-3
、Cl-
B.无色溶液中:Fe3+、SO
2-4
、NO
-3
、K+
C.pH=1的溶液中:Fe2+、NH
+4
、Mg2+、NO
-3
D.水电离的c(H+)=10-12mol?L-1的溶液中:Ca2+、Na+、Cl-、HCO
-3
参考答案:A.pH=11的溶液,显碱性,该组离子之间不反应,能大量共存
本题解析:
本题难度:简单
3、选择题 下列情况下,一定能在溶液中同时大量共存的离子组是
A.pH=2的溶液中:SO42-、K+、NO3-、Mg2+
B.使pH试纸呈现红色的溶液中:Fe2+、K+、NO3-、Na+
C.由水电离出的c(H+)=10ˉ12mol/L的溶液中:Na+、HCO3-、Cl-、SO42-
D.中性溶液中:Fe3+、Al3+、NO3-、I-、Cl-
参考答案:A
本题解析:
试题分析:A、pH=2的溶液是酸性溶液,在酸性溶液中这些离子是共存的,符合题意;B、使pH试纸呈现红色的溶液显酸性,H+、Fe2+、NO3-三种离子不能共存,发生氧化还原反应;C、由水电离出的c(H+)=10ˉ12mol·L-1,该溶液可能显酸性也可能显碱性,HCO3-既能与H+反应生成CO2↑,又能与OH-反应生成CO32-,不共存;D、NO3-、I-、Cl-是强酸根离子,不水解,Fe3+、Al3+是弱碱根离子,水解溶液显酸性,溶液中的离子Fe3+、Al3+、NO3-、I-、Cl-溶液不能显中性,不能共存。
考点:考查规定条件下离子共存的问题。
本题难度:困难
4、填空题 (10分)某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题:
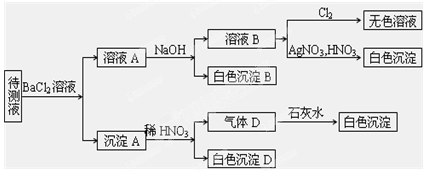
(1)待测液中是否含有SO42-、SO32-:_____________________ 。
(2)沉淀B的化学式为_________;生成沉淀B的离子方程式为
___________________ __。
(3)根据以上实验,待测液中肯定没有的离子是___________________; 肯定存在的离子还有________________________。
参考答案:⑴至少含有一种离子
⑵BaCO3,2HCO3-+Ba2
本题解析:
试题分析:待测液和氯化钡反应生成沉淀A,说明待测液中含有SO42-、SO32-、CO32-中的一种、两种或三种,向沉淀中加稀硝酸后,沉淀部分溶解生成气体,说明待测液中含有CO32-,BaSO3能被硝酸氧化生成BaSO4,所以此实验证明待测液中含有SO42-、SO32-中的一种或两种,二氧化碳和氢氧化钙反应生成BaCO3白色沉淀;溶液A中加NaOH生成沉淀,NaOH和HCO3-反应生成CO32-,CO32-和Ba2+反应生成BaCO3沉淀,说明待测液中含有HCO3-,溶液B中加入氯气得无色溶液说明没有Br-、S2-;加入硝酸和硝酸银有AgCl白色沉淀,这是由于前期加入了氯化钡是所至,故不能确定是否有Cl-。
⑴通过以上分析知,待测液中含有SO42-、SO32-中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种;
⑵通过以上分析知,沉淀B是BaCO3;生成沉淀B的离子方程式为2HCO3-+Ba2++2OH- = BaCO3↓+2CO32-+2H2O(NaOH过量);
⑶待测液中肯定没有的离子是Br-、S2-;肯定存在的离子还有CO32-、HCO3-。
考点:考查离子反应。
本题难度:一般
5、选择题 某无色溶液中加入铁粉产生氢气,则下列离子组合中可能大量共存的是( )
A.Al3+,Mg2+,Cl-,SO42-
B.K+,Na+,Cl-,HCO3-
C.Fe2+,K+,OH-,SO42-
D.K+,Ca2+,CO32-,Cl-
参考答案:A、离子之间不发生任何反应,能大量共存,且与H+离子不反应,
本题解析:
本题难度:简单
网站客服QQ: 960335752 - 14613519 - 791315772