微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某实验小组对普通锌锰废干电池内的黑色固体进行探究,设计如下方案:
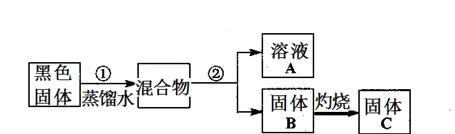
己知:I、普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。
II、氢氧化锌为白色粉末,不溶于水,溶于酸、强碱溶液和氨水。
请回答以下问题:
(1)②操作的名称是___________。
(2)某同学猜想溶液A的成分含有NH4Cl和ZnCl2,请你设计一个实验方案,验证其猜想正确,要求在答题卡上按下表格式写出实验操作、预期现象和结论。
限选试剂:蒸馏水、2moL·L-1 HCI 、2 moL·L-1 HNO3 、2 moL·L-1 NH3·H2O、6 moL·L-1 NaOH、0.1 moL·L-1 KSCN、0.1 moL·L-1 BaCl2、0.1 moL·L-1 AgNO3、紫色石蕊试液、红色石蕊试纸
实验操作
| 预期现象
| 结论
|
步骤1:各取少量溶液A分装a、b、c三支试管,往a试管,__
__________________________
| 有白色沉淀产生
| 说明溶液A含有Cl-
|
步骤2:往b试管,__________
__________________________
| ______________________
| _______________________
|
步骤3:往c试管,__________
__________________________
| 先产生_______________,
后____________________
| 说明溶液A含有Zn2+
?
(3)取少量固体c放入试管,滴加入双氧水,观察到有气体产生,写出该反应的化学方程式:_______________。
(4)为测定废干电池中二氧化锰的质量分数,进行下面实验:准确称取ag废千电池固体,溶于稀硫酸,加入碘化钾溶液,充分反应后,用bmol/L硫代硫酸钠标准溶液滴定,用淀粉作指示剂,滴定至终点,重复实验,平均消耗硫代硫酸钠标准溶液的体积为vmL,则废电池中二氧化锰的质量分数的计算表达式为:________________________________。
(滴定有关反应:MnO2+2I-+4H+=Mn2++I2+2H2O;I2+2S2O32-=2I-+S4O62-)
参考答案:(17分)
(1)过滤 (2分)??
(2)(共
本题解析:
试题分析:(1)依题意,普通锌锰废干电池内的黑色固体加足量蒸馏水溶解时,得到固液不相溶的混合物,二氧化锰不溶于水,氯化铵、氯化锌是可溶性盐,则操作②为过滤,将①所得混合物分离为溶液A和固体B,A的主要成分是氯化铵、氯化锌,B的主要成分是二氧化锰;(2)检验溶液A的主要成分,就是设计实验方案检验是否存在氯离子、铵根离子和锌离子,氯离子常用稀硝酸和硝酸银溶液检验,铵根离子常用热氢氧化钠溶液和湿润的红色石蕊试纸检验,锌离子常用氢氧化钠或氨水检验;步骤1:各取少量溶液A分装a、b、c三支试管,往a试管,滴加适量0.1mol?L-1AgNO3和2moL?L-1 HNO3溶液,产生白色沉淀,说明溶液A含有Cl-;步骤2:往b试管, 加入适量6moL?L-1NaOH、加热,将湿润的红色石蕊试纸置于试管口附近,湿润的红色石蕊试纸变蓝色,说明溶液A含有NH4+;步骤3:步骤3:往c试管,逐滴加入2moL?L-1NH3·H2O 或 6moL?L-1NaOH至过量,先产生 白色沉淀,后白色沉淀溶解,说明溶液A含有Zn2+;(3)二氧化锰固体受热不能分解,则固体C的成分是二氧化锰,双氧水在二氧化锰催化下,分解反应速率增大,生成水和氧气;(4)依题意,由于n=c?V,则硫代硫酸钠的物质的量为bv×10—3mol;由于I2+2S2O32-=2I-+S4O62-中各物质的系数之比等于物质的量之比,则每次滴定消耗的I2为 bv/2×10—3mol;由于MnO2+2I-+4H+=Mn2++I2+2H2O中各物质的系数之比等于物质的量之比,则样品中MnO2为 bv/2×10—3mol;由于二氧化锰的式量为87,m=n?M,则样品中MnO2的质量为87bv/2×10—3g;由于样品的质量为ag,则样品中MnO2的质量分数的表达式为87bv/2a×10—3×100%。
本题难度:困难
2、选择题 粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质。①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤
正确的操作顺序是
[???? ]
A.③②①⑤④
B.②③①④⑤
C.①③②⑤④
D.③⑤②①④
参考答案:A
本题解析:
本题难度:一般
3、实验题 (16分)某学习小组以 溶液作试剂,设计提纯含有少量 溶液作试剂,设计提纯含有少量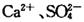 的粗盐。其实验方案如下: 的粗盐。其实验方案如下:
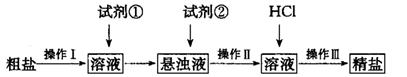
(1) 操作I的名称为________;试剂①应选用_______;检验试剂②是否过量的方法______。
(2) 操作I?III共用到玻璃棒________次;从悬浊液到精盐的实验过程中,某同学未按上述方案进行,最终导致精盐纯度偏低。其做法可能是________________。
(3)测定产品精盐中NaCl的含量的实验步骤是:
第一步:准确称取a g干燥精盐于锥形瓶中,加人30. OmL蒸馏水。
第二步:向上述锥形瓶中加人几滴突光素指示剂。
第三步:用浓度为的AgNO3标液滴至终点(溶液呈浅红色),消耗AgNO3溶液V mL。
①盛装干燥精盐的烧杯应放在________中保存(填仪器名称);
②终点时溶液呈浅红色是荧光素指示剂与________反应(填“Ag+”或"NO3-”);
③某同学在第二次滴定时,滴定前,后管内液面分别如图,则其所得V=________mL;

④NaCl的质量分数为________ (用字母表示)
参考答案:(1)除去;BaCl2溶液;静止悬浊液,取适量的的上层清液于
本题解析:除Ca2+和SO42-分别需要碳酸钠和氯化钡,但过量的氯化钡还需要碳酸钠来除去,因此在除去Ca2+前需要先除去SO42-,多余的碳酸钠可用盐酸来除去。但再加入盐酸之前要先过滤除去沉淀,然后才能加入盐酸。试剂②是碳酸钠溶液,若碳酸钠不过量,则继续加入会产生白色沉淀,所以检验其是否过量的方法为:静止悬浊液,取适量的的上层清液于试管中,滴入适量碳酸钠溶液,若不出现混浊则试剂②已经过量,反之则不过量;若所制取的精盐纯度偏低有可能是加盐酸前没有过滤,或盐酸量不足或蒸发时尚有大量水未蒸干;为了防止精盐吸水需要放在干燥器中。因为Ag+与Cl-结合生成了白色沉淀,而NO3-并没有参与反应,所以只有当Ag+过量是才能发生颜色的变红,因此荧光素指示剂与反应的Ag+。滴定前后的读数分别未2、30ml和21.40ml,所以V=19.10mL。消耗AgNO3的量是0.0001Vmol,所以氯化钠的质量是5.85V×10-3g,所以NaCl的质量分数为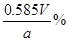 。 。
本题难度:一般
4、选择题 室温时,在体积相同的密闭容器中混合下列气体,混合后容器内压强最小的是
A.100 mLH2和50 mLO2
B.100 mLNO和50 mLO2
C.100 mLHCl和50 mLNH3
D.100 mLH2S和50 mLSO2
参考答案:D
本题解析:
本题难度:简单
5、选择题 下述实验设计能够达到目的的是
编号
| 实验目的
| 实验设计
| A
| 除去CO2中少量的SO2
| 将混合气体通过饱和Na2CO3溶液
| B
| 除去Cu粉中混有的CuO
| 向混合物中滴加适量稀硝酸
| C
| 检验溶液中是否含有Fe2+
| 向溶液中滴入氯水后,再滴加KSCN溶液
| D
| 证明H2CO3酸性比H2SiO3强
| 将CO2通入Na2SiO3溶液中
参考答案:D
本题解析:
试题分析:A、二氧化碳、二氧化硫都与碳酸钠溶液反应,不符合除杂的原则,错误;B、Cu与CuO都与硝酸反应,不符合除杂的原则,错误;C、检验溶液中是否含有亚铁离子,应先加入KSCN溶液,溶液不变红,再向溶液中滴加氯水,溶液变红色,说明溶液中存在亚铁离子,直接加入氯水,不能判断原溶液中含有亚铁离子,错误;D、将CO2通入Na2SiO3溶液中,若出现白色沉淀,证明碳酸酸性比硅酸酸性强,正确,答案选D。
本题难度:一般
|
|