微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在VmLAl2(SO4)3溶液中含有Al3+m g, 取V/4mL该溶液用水稀释至4VmL,则SO42-的物质的量浓度为 ( )
A.125m / 9V mol/L
B.125m / 36V mol/L
C.125m / 54V mol/L
D.125m / 18V mol/L
参考答案:B
本题解析:
试题分析:Vml溶液中含有Al3+mg,则根据化学式可知,Vml溶液中SO42-物质的量为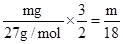 mol,其浓度为
mol,其浓度为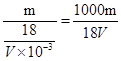 mol/L,取V/4mL该溶液用水稀释至4VmL,浓度为
mol/L,取V/4mL该溶液用水稀释至4VmL,浓度为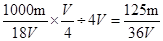 ,答案选B.
,答案选B.
考点:一定物质的量浓度的溶液的计算
本题难度:一般
2、计算题 (8分)使一定量Zn与100 ml 18.5 mol/L浓H2SO4充分反应,Zn完全溶解,同时生成标准状况下气体33.6L。将反应后溶液稀释至1L,测得其c(H+) = 0.1mol/L。求:
(1)生成气体的成分为: ;
(2)Zn的质量为 g;
(3)开始生成H2时H2SO4的浓度为 mol/L。(假设溶液体积无变化)
参考答案:(1) SO2,H2(2分
本题解析:考查根据化学反应方程式进行的有关计算。浓硫酸属于氧化性酸,和锌反应生成SO2。但随着反应的进行,硫酸的浓度会逐渐降低,当浓度降低到一定程度后,就变成稀硫酸。稀硫酸和锌反应生成的是氢气,即33.6L气体是SO2和氢气的混合气。反应前硫酸的物质的量是0.1L×18.5mol/L=1.85mol,反应后硫酸的物质的量是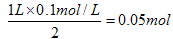 ,所以参加反应的硫酸是1.85mol-0.05mol=1.8mol。33.6L气体的物质的量是1.5mol,设混合气中SO2和氢气的物质的量分别是x和y,则根据反应式可知
,所以参加反应的硫酸是1.85mol-0.05mol=1.8mol。33.6L气体的物质的量是1.5mol,设混合气中SO2和氢气的物质的量分别是x和y,则根据反应式可知
Zn+2H2SO4(浓) ZnSO4+2H2O+SO2↑ 、 Zn+H2SO4=ZnSO4+H2↑
ZnSO4+2H2O+SO2↑ 、 Zn+H2SO4=ZnSO4+H2↑
1mol 2mol 1mol 1mol 1mol 1mol
X 2x x y y y
所以有x+y=1.5mol和2x+y=1.8mol
解得x=0.3mol y=1.2mol
所以锌的质量是(x+y)×65g/mol=97.5g
当开始生成氢气时溶液中的硫酸是1.85mol-2x=1.25mol
所以浓度是12.5mol/L
本题难度:一般
3、选择题 下列说法正确的是
A.2.24 L CO2中共有的原子数为0.3×6.02×1023
B.1.8 g N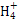 共有的质子数为6.02×1023
共有的质子数为6.02×1023
C.1 mol重水分子所含中子数为10×6.02×1023
D.7.8 g Na2O2中含有的阴离子数为0.2×6.02×1023
参考答案:C
本题解析:标准状况下,2.24 L CO2中含有的原子数为0.3×6.02×1023,A错误;1个N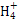 含有11个质子,1.8 g N
含有11个质子,1.8 g N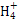 本题难度:一般
本题难度:一般
4、计算题 (8分)将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸中。向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如右图所示。求:
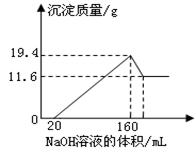
(1)19.4g沉淀中含有Al(OH)3的质量;
(2)当Al(OH)3完全溶解时所加入的NaOH溶液的体积为??????????;
(3)盐酸的物质的量浓度。
参考答案::(1)19.4-11.6=7.8g
(2) 180m
本题解析:
试题分析:
解:设镁的物质的量为x,铝的物质的量为y;过量HCl的物质的量为n。
(1)根据图可知:Mg(OH)2的质量为11.6g,Al(OH)3的质量为(19.4-11.6)g==7.8g
(2)设Al(OH)3完全溶解时消耗的NaOH物质的量为z,
Al(OH)3?+ NaOH = NaAlO2 + 2H2O
1mol???? 1mol
7.8/78???? z
z = 0.1mol
V(NaOH)=0.1/5=0.02L??即20m
本题难度:一般
5、选择题 将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.4mol·L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
A.5.3g
B.3.1g
C.4.2g
D.10.6g
参考答案:D
本题解析:
试题分析:Na+的物质的量为:0.5L×0.4mol·L-1=0.2mol,固体加 热最后物质是Na2CO3, Na+的物质的量为:0.2mol,那么Na2CO3的物质的量为0.1mol,质量为:0.1mol×106g/mol=10.6g,选D。
考点:元素守恒定律的应用和物质的量的计算。
本题难度:一般