微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ·mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ·mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ· mol-1
则Q1、Q2、Q3的关系表示正确的是
[???? ]
A. Q1=Q2
B. Q1 >Q3
C. Q3> Q2> Q1
D. Q1=Q2=Q3
2、选择题 现有如下三个热化学方程式:
(1)H2(g)+O2(g)===H2O(g),△H=a kJ·mol-1
(2)H2(g)+O2(g)===H2O(l),△H=b kJ·mol-1
(3)2H2(g)+ O2(g)===2H2O(l),△H=c kJ·mol-1
下列关于它们的表述正确的是[???? ]
A.它们都是吸热反应
B.a.b.c均为正值
C.a=b
D.2b=c
3、填空题 甲醇是一种重要的可再生能源,工业上可用CO和H2合成。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图。

根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K= ;
升高温度,K值 (填“增大”、“减小”
或“不变”)。
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是: ; (写出相关的化学方程式并辅以必要的文字说明)。
4、填空题 (8分)已知下列热化学方程式:
①H2(g)+ O2(g)===H2O(l)ΔH=-285.8 kJ/mol
O2(g)===H2O(l)ΔH=-285.8 kJ/mol
②H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ/mol
O2(g)===H2O(g) ΔH=-241.8 kJ/mol
③C(s)+ O2(g)===CO(g)ΔH=-110.5 kJ/mol
O2(g)===CO(g)ΔH=-110.5 kJ/mol
④C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ/mol
回答下列各问题:
(1)上述反应中属于放热反应的是 。
(2)C的燃烧热为 。
(3)CO的燃烧热为__________;其热化学方程式为__________________________。
5、填空题 饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3-的浓度,某兴趣小组提出如下方案:?
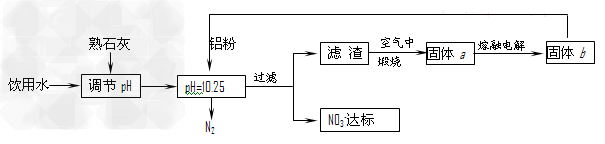
请回答下列问题:
⑴已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为 __________________________________________。
⑵该方案中选用熟石灰调节pH,理由是_______________________、__________________,在调节pH时,若pH过大或过小都会造成____________的利用率降低。
⑶用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为___________________________。
⑷饮用水中的NO3-???主要来自于NH4+。已知在微生物作用的条件下,NH4+???经过两步反应被氧化成NO3-???。两步反应的能量变化示意图如下:试写出1?mol?NH4+??(aq)全部氧化成NO3-???(aq)的热化学方程式是______________。
