微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 不需要放入棕色瓶存放的溶液是
A.浓硫酸
B.浓硝酸
C.浓氨水
D.硝酸银
参考答案:A
本题解析:见光易分解的物质一般需要保存在棕色瓶中,在4个选项中浓硫酸稳定,不易分解,所以答案是A。
本题难度:简单
2、选择题 将5.6gFe在一定量稀硝酸中恰好完全溶解后,往溶液中滴加NaOH溶液立即产生沉淀,滴加至沉淀量最大时止,再将所得溶液和沉淀一起加热蒸干并在空气中灼烧至恒重,所得固体成分和质量可能为
A.A
B.B
C.C
D.D
参考答案:AB
本题解析:分析:根据5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,5.6gFe的物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,或硝酸钠0.3mol,最后得到0.05mol氧化铁和0.2mol硝酸钠或0.3mol亚硝酸钠,可分别计算出亚硝酸钠的质量范围.
解答:如果25.6gFe的物质的量=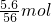 =0.1mol,铁全部恰好生成硝酸亚铁,则硝酸亚铁物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,
=0.1mol,铁全部恰好生成硝酸亚铁,则硝酸亚铁物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,
根据元素质量守恒可得加热生成0.05mol氧化铁和0.2mol亚硝酸钠,
质量是:氧化铁0.05mol×160g/mol=8g,亚硝酸钠0.2mol×69g/mol=13.8g
如果恰好生成硝酸铁0.1mol,则氧化铁依然是0.05mol,硝酸钠是0.3mol,
灼烧生成氧化铁4g,根据N元素守恒可得亚硝酸钠0.3mol,质量为0.3mol×69g/mol=20.7g
所以氧化铁质量肯定是4g,亚硝酸钠质量应该在[13.8,20.7]区间内,
故选AB.
点评:本题考查混合物的计算,题目难度较大,本题考虑5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,利用端值法求解,注意加热氢氧化亚铁时生成氧化铁而不是氧化亚铁,为易错点.
本题难度:简单
3、选择题 200℃时,11.6?g?CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6g,则原混合物的平均式量为
A.5.8
B.11.6
C.23.2
D.46.4
参考答案:C
本题解析:设CO2和H2O的物质的量分别是x和y,则根据反应的方程式2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑可知,28x+2y=3.6g。又因为44x+18y=11.6g,所以16x+16y=11.6g-3.6g=8.0g。因此x+y=0.5mol,所以原混合物的平均式量为11.6÷(x+y)=23.2,答案选C。
本题难度:简单
4、选择题 除去镁粉中混有的少量铝粉,可选用的溶液是
A.盐酸
B.硝酸
C.氨水
D.氢氧化钾
参考答案:D
本题解析:Mg不与强碱溶液发生反应,而铝可以与强碱溶液发生反应,铝与氢氧化钾反应的方程式为2Al+2KOH+2H2O 2KAlO2+3H2↑。故选D。
2KAlO2+3H2↑。故选D。
本题难度:简单
5、选择题 在冷的浓HNO3中,下列金属易发生钝化作用的是???
A.铜
B.镁
C.锌
D.铝
参考答案:D
本题解析:试题分析:A.Cu与冷的浓硝酸发生氧化还原反应而完全溶解,不发生钝化,故A不选;
B.Mg与冷的浓硝酸发生氧化还原反应而完全溶解,不发生钝化,故B不选;
C.Zn与冷的浓硝酸发生氧化还原反应而完全溶解,不发生钝化,故C不选;
D.常温下,Al遇浓硝酸发生钝化,阻止反应进一步发生,故D选。
故选D。
考点:硝酸的化学性质
点评:本题考查硝酸的强氧化性及钝化,明确发生钝化的金属只有Al、Fe是解答本题的关键,题目难度不大。
本题难度:一般