微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、
D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶
液呈碱性,E与C的最外层电子数相同。
(1)画出D的原子结构示意图 ,E元素在周期表中的位置是 。
(2)A与C形成原子个数比为1:1的化合物甲,其中含有化学键类型为 。
(3)D与C按原子个数比为1:1形成化合物的电子式是 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是& 91ExAM.org#160; (填具体的化学式)。
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与 C形成的化合物甲反应的离子方程式 。
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式: ;放电时溶液中H+移向 (填“正”或“负”)极。
(7) E(s)+O2(g) EO2(g) △H1 E(g)+O2(g) EO2(g) △H2,则△Hl △H2(填“>”或“<”或“=”)。
参考答案:(共14分)(1) 本题解析:
本题解析:
试题分析:(1)A、B组成的气态化合物的水溶液呈碱性,所以A是H元素,B是N元素,二者形成的化合物是氨气,水溶液呈碱性;A、[D都能与C按原子个数比为1:1或2:1形成化合物,则D是Na,C是O,形成的化合物氧化物与过氧化物均是原子个数比为1:1或2:1,E与C的最外层电子数相同,则E是S元素。D的原子结构示意图是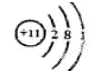 ,E在元素周期表则的位置是第三周期第VIA族;
,E在元素周期表则的位置是第三周期第VIA族;
(2)A与C形成原子个数比为1:1的化合物甲是过氧化氢,化学键类型是共价键;
(3)D与C按原子个数比为1:1形成化合物是过氧化钠,属于离子化合物,电子式为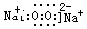 ;
;
(4)N的非金属性比O弱,所以B、C所形成氢化物水的稳定性大于氨气,稳定性由强到弱的顺序是H2O、NH3;
(5)F金属投入到盐酸溶液中,生成了浅绿色溶液M,则M是氯化亚铁,F是Fe,氯化亚铁与过氧化氢在酸性条件下发生氧化还原反应,生成铁离子和水,离子方程式为2Fe2++H2O2+2H+=2Fe3++H2O;
(6)以氢气、氮气为原料的电池的正极是氮气发生还原反应,结合电解质溶液氮气得电子与氢离子结合生成铵根离子,电极反应式为N2+6e-+8H+=2NH4+;原电池中的阳离子移向正极,所以放电时溶液中H+移向正极;
(7)固体熔化为液体需要吸热,所以气态S完全燃烧放出的热量多,则△Hl>△H2
考点:考查元素的判断,元素及其化合物的性质应用,电化学反应原理、热效应的判断
本题难度:一般
2、选择题 S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) === SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) === SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) === S(正交,s) △H3
下列说法正确的是( )
A.△H3=—0.33 kJ·mol-1
B.单斜硫的能量比正交硫的能量低
C.S(单斜,s)===S(正交,s)△H3>0,正交硫比单斜硫稳定
D.S(单斜,s)===S(正交,s)△H3<0,单斜硫比正交硫稳定
参考答案:A
本题解析:根据盖斯定律可知,①-②即得到③,所以△H3=-297.16 kJ·mol-1+296.83 kJ·mol-1
=—0.33 kJ·mol-1,A正确。由于能量越低越稳定,所以正交硫比单斜硫稳定,BCD都是错误的,答案选A。
本题难度:简单
3、选择题 氢气在氧气中燃烧时产生明亮的淡蓝色火焰。在反应过程中,破坏1 mol氢气中的H—H键消耗的能量为Q1 kJ,破坏1 mol氧气中的O—O键消耗的能量为Q2 kJ,形成1 mol水中的H—O—H键需要的能量为Q3 kJ。下列关系式正确的是(???)
A.2Q1+Q2>Q3
B.2Q1+Q2>2Q3
C.Q1+Q2<Q3
D.2Q1+Q2<2Q3
参考答案:B
本题解析:氢气燃烧是一放热反应,同时释放出光能。依据反应方程式2 H2+O2====2H2O,知2Q1+Q2>2Q3。
本题难度:简单
4、选择题 已知反应:①101kPa时,2C(s)+O2(g)==2CO(g);ΔH="-221" kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH="-57.3" kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀Ba(OH) 2溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
参考答案:A
本题解析:
试题分析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据反应①可知1mol碳完全燃烧放出的热量一定是大于110.5kJ,A正确;B不正确,反应热必须注明“+”或“-”;中和热不必注明“+”或“-”,C不正确;醋酸是弱酸存在电离平衡,而电离是吸热的,所以稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ,D不正确,答案选A。
考点:考查燃烧热、中和热的有关判断。
本题难度:一般
5、填空题 两个硫酸分子可以脱去1分子水生成焦硫酸(H2S2O7),已知硫酸的分子中有4个硫氧键,则焦硫酸分子中硫氧键的数目是______.
参考答案:硫酸的分子中有4个硫氧键,两个硫酸分子可以脱去1分子水生成焦
本题解析:
本题难度:一般