微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 2011年8月12日,《云南信息报》首度披露?了云南曲靖铬污染事件,引起全国广泛关注.工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为:SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等.
已知:①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌:+3价铬不易被人体吸收,毒性小.
③下表为一些金属氢氧化物沉淀的pH参照数据.
| 物质 | ?开始沉淀 | ?完全沉淀
?Fe(OH)3
?2.7
?3.7
?Al(OH)3
?3.7
?4.7
?Cr(OH)3
?4.7
?a
?Fe(OH)2
?7.6
?9.6
?Mg(OH)2
?9.6
?11.1
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4?7H2O),加入绿矾的目的是______.
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是______;常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5mol?L-1视为沉淀完全],溶液的pH应调于a=______.
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含______溶质的溶液.
参考答案:(1)根据污水中物质的含量可知,加入硫酸后,除SiO2不溶过
本题解析:
本题难度:一般
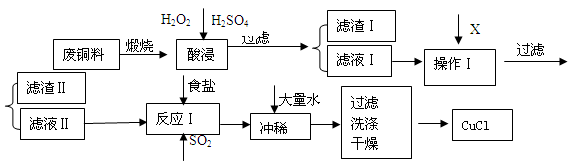
2、简答题 (14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
物质
| 开始沉淀
| 沉淀完全
| Fe(OH)3
| 2.7
| 3.7
| Cu(OH)2
| 5.6
| 6.7
| Al(OH)3
| 3.8
| 4.7
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是: 。
(2)操作Ⅰ为调节溶液的PH值,范围为 ,加入的物质X可以是( )
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
(3)滤渣Ⅱ的主要成分是 。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式: 。
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是: 。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O  CuOH + H+的平衡常数为: 。 CuOH + H+的平衡常数为: 。
参考答案:(1)使铜转化为可溶于酸的氧化物 (2)4.7≤PH<
本题解析:
试题分析:(1)煅烧的主要目的是使铜转化为可溶于酸的氧化物。(2)操作Ⅰ为调节溶液的PH值,要想溶液中加入的物质消耗H+,同时不引入新的杂质离子,对后边的形成CuCl沉淀有利的物质,应该是CuO、Cu(OH)2、NaOH 溶液。因此选项为A、B、C。调整溶液的pH的范围应该是使杂质离子形成沉淀除去而Cu2+留在溶液中,根据表格提供的数据,应该在4.7~5.6。(3)此时产生的滤渣Ⅱ的主要成分是Fe(OH)3 和Al(OH)3;(4)往滤液Ⅱ中加入食盐并通入SO2发生氧化反应反应,可生成CuCl2-,该反应的离子方程式是2H2O+2Cu2++SO2+4Cl-="2" CuCl2-+ SO42-+4H+;(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是提高的CuCl2—生成速率;(6)因为在常温下,已知CuOH的KSP为1.0×10-14,所以c(Cu+)=1.0×10-14÷10-7=10-7mol/L;Cu++H2O  CuOH + H+的平衡常数为 CuOH + H+的平衡常数为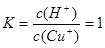 . .
考点:考查生产CuCl的反应原理、操作方法、实验条件的选择、离子方程式的书写、沉淀溶解平衡的应用。
本题难度:困难
3、选择题 已知某氢氧化物 的溶度积常数为 的溶度积常数为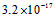 ,则 ,则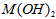 在水中的溶解度为[???? ] 在水中的溶解度为[???? ]
A.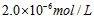
B.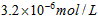
C.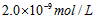
D.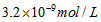
参考答案:A
本题解析:
本题难度:一般
4、选择题 已知在25℃时,氯化银的Ksp=1.8×10-10,现将足量氯化银分别放入下列溶液中,相同温度下c(Ag+)最大的是
A.100mL蒸馏水
B.100mL 0.2mol·L-1 AgNO3
C.100 mL 0.1mol·L-1AlCl3
D.100mL 0.1 mol·L-1盐酸
参考答案:B
本题解析:
试题分析:B、正确,溶液中本身的c(Ag+)已经远远大于氯化银电离的c(Ag+)。
本题难度:一般
5、选择题 已知Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是(??)
A.AgCl不溶于水,不能转化为AgI
B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必不低于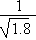 ×10-11 mol·L-1 ×10-11 mol·L-1
参考答案:A
本题解析:根据溶度积常数可知,只要溶液中c(Ag+)·c(I-)>Ksp(AgI),就会产生碘化银沉淀,所以A是错误的。沉淀往往向生成更难溶的方向转化,所以选项BC都是正确的。要生成碘化银沉淀,则c(Ag+)·c(I-)>Ksp(AgI)。因为在氯化银溶液中,c(Ag+)=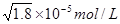 ,所以此时c(I-) > ,所以此时c(I-) > 本题难度:一般 本题难度:一般
|
|