微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ?2NH3(g) ?△H=" -92.4" kJ/mol??据此回答以下问题:
?2NH3(g) ?△H=" -92.4" kJ/mol??据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是???????(填序号)。
①反应压强为20Mpa~50Mpa??②500℃的高温???③铁触媒作催化剂??④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
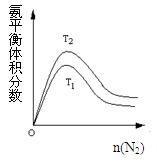
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2????T1(填>、=、<),判断的依据是:????????????????????????????????????????????????????????????????
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g) H
H 2(g)+CO(g) 平衡常数K1
2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g) H2(g)+CO2(g)?平衡常数K2
H2(g)+CO2(g)?平衡常数K2
① K1的表达式:K1=????????????????????????
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
实验组别
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
H2O
| CO
| H2
| CO
|
1
| 650
| 1
| 2
| 0.8
| 1.2
| 5
|
2
| 900
| 0.5
| 1
| 0.2
| 0.8
| 3
|
3
| T
| a
| b
| c
| d
| t
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为???????????????????
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为??????????(填序号)
A.其它条件不变温度T<900℃
B.其它条件不变温度T>900℃
C.充入一定量氖气
D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2???????(填“增大”、“减小”或“不变”)。
参考答案:
 本题解析:氨气 本题解析:氨气
本题难度:一般
2、填空题 一工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):

已知① A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
② IV中的电解反应式为MnSO4+ZnSO4+2H2OMnO2+ Zn+2H2SO4。
(1)A中属于还原产物的是___________。
(2)MnCO3、Zn2(OH)2CO3的作用是_____________________________;II需要加热的原因是___________;C的化学式是____________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是______________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是___________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是__________。
参考答案:
(1)MnSO4???
(2)增大溶液的pH,
本题解析:略
本题难度:简单
3、填空题 海水中有丰富的化学资源,从海水中可提取多种化工原料,下图是海水综合利用——合成氨——纯碱的联合生产工艺流程:
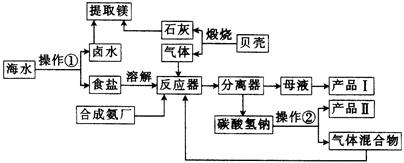
(1)写出反应器中发生反应的化学方程式: 。
(2)分离器中进行的操作名称是 ,图中操作①是 。
(3)产品Ⅱ是 (填化学 式)。 式)。
(4)写出合成氨厂里用天然气和水蒸气在催化剂和高温下反应制备原料气H2的化学方程式: 。
(5)设计用卤水和石灰及其他必要试剂提取镁的过程:(用化学方程式表示)。
参考答案:(1) 本题解析:略 本题解析:略
本题难度:一般
4、选择题 绿色化学提倡化工生产应提高原子利用率.原子利用率表示目标产物的质量与生成物总质量之比.在下列氮肥的制备反应中,原子利用率不是100%是( )
A.NH3+H2O+CO2=NH4HCO3
B.2NH3+CO ?180~200℃?
.
15~30MPa
H2O+CO(NH2)2
C.NH3+HNO3=NH4NO3
D.NH3+HCl=NH4Cl
参考答案:B
本题解析:
本题难度:简单
5、选择题 (1)1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4;2NaCl+H2SO4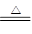 ?Na2SO4+2HCl↑ ?Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S;Na2SO4+4C Na2S+4CO↑ Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3;Na2S+CaCO3 Na2CO3+CaS Na2CO3+CaS
(2)下列说法正确的是??????????? ( )。
A.②③两步都是氧化还原反应
B.只有第②步是氧化还原反应
C.该方法对生产设备基本没有腐蚀
D.该方法对环境污染较小
参考答案:B
本题解析:依据氧化还原反应是有化合价变化的反应可知,第②步是氧化还原反应,故A错,B对;该生产中产生HCl,对生产设备严重酸蚀;第②步产生的CO是大气污染物,故C、D错。
本题难度:简单
|
|
网站客服QQ: 960335752 - 14613519 - 791315772