微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 Na2CO3 水溶液中存在CO32—+ H2O  ?HCO3—+OH—平衡。下列说法不正确的是
?HCO3—+OH—平衡。下列说法不正确的是
A.稀释溶液,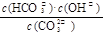 增大
增大
B.通入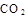 ,溶液pH减小
,溶液pH减小
C.升高温度,此平衡常数增大
D.加入NaOH固体,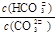 减小
减小
参考答案:A
本题解析:该水解平衡的平衡常数表达式为K=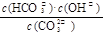 ,平衡常数只与温度有关温度不变平衡常数不变,A错误;通入二氧化碳会与溶液中的氢氧根反应,溶液中氢氧根浓度下降,PH减小,B正确;水解吸热升高温度平衡向正向移动,平衡常数增大,C正确;加入NaOH固体,平衡向左移动,HCO3—浓度减小, CO32—浓度增大,
,平衡常数只与温度有关温度不变平衡常数不变,A错误;通入二氧化碳会与溶液中的氢氧根反应,溶液中氢氧根浓度下降,PH减小,B正确;水解吸热升高温度平衡向正向移动,平衡常数增大,C正确;加入NaOH固体,平衡向左移动,HCO3—浓度减小, CO32—浓度增大, 本题难度:一般
本题难度:一般
2、选择题 对于0.1 mol·L-1 Na2SO3溶液,正确的是(?? )
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32―)+c(HSO3-)+c(H2SO3)
C.c(Na+)+c(H+)=2c(SO32―)+2c(HSO3-)+c(OH―)
D.加入少量NaOH固体,c(SO32―)与c(Na+)均增大
参考答案:D
本题解析:Na2SO3为弱酸强碱盐,水解显碱性,水解是吸热反应,所以温度升高,水解程度增大,其pH增大,故A不正确;B项考查物料守恒,正确的表达式为c(Na+)=2c(SO32―)+2c(HSO3-)+2c(H2SO3),故B不正确;C项是考查电荷守恒,其正确的表达式为c(Na+)+c(H+)=2c(SO32―)+c(HSO3-)+c(OH―),故C不正确;加入少量NaOH固体,抑制其水解,水解程度降低,c(SO32―)与c(Na+)均增大,故D正确。
本题难度:一般
3、选择题 实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里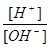 =10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
A.C(B+)>C(A-)>C(OH-)>C(H+)?????????? B.C(A-)>C(B+)>C(H+)>C(OH-)
C.C(B+)=C(A-)>C(H+)=C(OH-)?????????? D.C(B+)>C(A-)>C(H+)>C(OH-)
参考答案:C
本题解析:
分析:常温下0.1mol/L某一元酸(HA)溶液的pH等于l,说明HA完全电离,为强酸,0.1mol/L某一元碱(BOH)溶液里
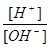 =10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,以此解答该题.
=10-12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=0.1mol/L,则BOH为强碱,二者反应生成强碱强酸盐,溶液呈中性,以此解答该题.
解
本题难度:一般
4、选择题 下列离子方程式中,属于水解反应的是(?? )
A.HCOOH+H2O HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O HCO3-+H+
HCO3-+H+
C.CO32-+H2O HCO3-+OH-
HCO3-+OH-
D.HS-+H2O S2-+H3O+
S2-+H3O+
参考答案:C
本题解析:A、D项分别表示HCOOH、HS-的电离过程,B项表示的是二氧化碳与水反应后生成碳酸的电离方程式,C项表示的是碳酸根离子结合水电离的氢离子生成碳酸氢根离子,属于水解反应。
本题难度:简单
5、选择题 下列水解离子方程式正确的是:(?????)
A.CH3COO— + H2O CH3COOH + OH-
CH3COOH + OH-
B.NH4+ + H2O NH4OH + H+
NH4OH + H+
C.Fe3+ + H2O Fe(OH)3 + H+
Fe(OH)3 + H+
D.Al3+ + 3HCO3-="=" Al(OH)3↓ + 3CO2↑
参考答案:AD
本题解析:
试题分析:B中应生成NH3·H2O,B错误;C中未配平,C错误。
点评:盐类水解的实质是盐电离出来的离子与水电离出来的氢离子或氢氧根离子结合生成弱电解质的反应;铝离子水解呈酸性、碳酸氢根离子水解呈碱性,二者水解相互促进,发生双水解反应。
本题难度:一般