微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一个密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是??????????????
2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是??????????????
A.SO2为0.4mol/L,O2为0.2mol/L
B.SO3(g)为0.4mol/L
C.SO2、SO3(g)均为0.15mol/L
D.SO2为0.25mol/L
参考答案:D
本题解析:可采用极值法。若全部转化为生成物,则SO3的浓度是0.4mol/L。若全部转化为反应物则SO2、O2的浓度分别为0.4mol/L、0.2mol/L。因为是可逆反应,所以选项A、B不可能。由硫原子守恒可知,SO2和SO3的浓度之和应满足0.4mol/L,即C也不可能。答案是D。
本题难度:简单
2、选择题 0℃时,将0.1mol?N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)?2NO2(g).下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2的生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化.
A.②③⑥⑦
B.①④⑧
C.只有①④
D.只有⑦⑧
参考答案:①无论反应是否达到平衡状态,N2O4的消耗速率与NO2的生成
本题解析:
本题难度:一般
3、选择题 对于在恒容、恒温密闭容器中进行的反应H2(g)+I2(g)

2HI(g),能说明其达到化学平衡状态的是( )
A.容器中气体压强不变
B.容器中气体密度不变
C.容器中气体颜色的深浅不变
D.同时间内生成的H2、I2的物质的量相同
参考答案:A、该反应是一个反应前后气体体积不变的化学反应,无论该反应是
本题解析:
本题难度:一般
4、选择题 一定条件下,发生可逆反应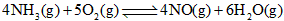 。下列叙述中,不能做为此可逆反应已经达到化学平衡状态的标志是[???? ]
。下列叙述中,不能做为此可逆反应已经达到化学平衡状态的标志是[???? ]
A.NH3的消耗速率等于NO的生成速率
B.NH3的消耗速率等于NO的消耗速率
C.NH3的浓度和NO的浓度都不发生改变
D.密闭容器内的压强不发生改变
参考答案:A
本题解析:
本题难度:一般
5、填空题 煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
温度/℃
| 400
| 500
| 800
|
平衡常数K
| 9.94
| 9
| 1
试回答下列问题:
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有????(选填A、B、C、D、E);
|