微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知: Cu (s)+2H+(aq)=Cu2+(aq)+ H2(g) △H 1
2H2O2(l)=2H2O(l) + O2 (g) △H 2
2H2(g) + O2(g)=2H2O(l) △H 3
则反应 Cu (s)+H2O2(l)+2H+ (aq)=Cu2+(aq)+ 2H2O(l) 的△H是
A.△H=△H 1+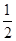 △H 2+
△H 2+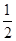 △H 3
△H 3
B.△H=△H 1+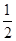 △H 2-
△H 2-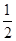 △H 3
△H 3
C.△H=△H 1+2△H 2+2△H 3
D.△H=2△H 1+△H 2+△H 3
2、简答题 (14分)用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是
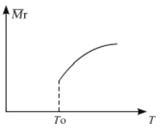
A.该反应在任何温度下可自发进行
B.若混合气体的总质量不变,表明上述反应己达到平衡状态
C.其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在___(填"T1”、“T2”.,“T3”)温度下反应达到平衡所需时间最长:

假设温度为T1时向该反应容器中同时加入。(SiC14) =0.3 mol/L,c(H2) =0.3 mol/L,,c(N2) =
x mol/L, c (HCl) =0.3 mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值
范围为___
(4)该反应的原子利用率为____
(5)工业上制备SiCl4的反应过程如下:
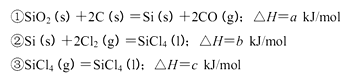
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiC14和一氧化碳的热化学方程式_____
3、选择题 在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化如下图所示。下列说法不正确的是
 [???? ]
[???? ]
A. △H1<△H2
B. 第一步反应放热546 kJ时转移电子12 mol
C. 1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(g) △H=-346kJ/mol
D. 两步反应因各自反应物的总能量大于生成物的总能量故二者都是放热反应
4、选择题 乙醇可通过淀粉等物质原料发酵制得,属于可再生资源,通过乙醇制取氢气具有良好的应用前景。已知通过乙醇制取氢气有如下两条路线:
a.水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) ΔH=+255.58 kJ·mol-1
b.部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g) ΔH=+13.76 kJ·mol-1
则下列说法错误的是 [???? ]
A.从原料消耗的角度来看,a路线制氢更有价值
B.从能量消耗的角度来看,b路线制氢更加有利
C.a路线制氢由于要消耗很多能量,所以在实际生产中意义不大
D.b路线反应,是由高能量向低能量的反应
5、选择题 下列说法正确的是 [???? ]
A.可以用乙醇萃取溴水中的溴单质
B.表示甲醇燃烧热的热化学方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-362.88 kJ/mol
C.加入稀硝酸和BaCl2溶液产生白色沉淀的溶液中一定含SO42-
D.玻璃棒在配制0.1 mol/L NaCl溶液与粗盐提纯的实验中所起的作用相同