微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式中正确的是(??)
A.稀硫酸与氢氧化钡溶液反应 H++OH-= H2O
B.硫酸铝溶液中滴入氨水 Al3++OH-=Al(OH)3↓
C.将足量CO2通入偏铝酸钠溶液中 Al3++CO2+H2O=Al(OH)3↓+CO32-
D.硝酸铝溶液中滴加少量氢氧化钠溶液 Al3++3OH-=Al(OH)3↓
参考答案:D
本题解析:
试题分析:A不正确,因为反应中还有硫酸钡白色沉淀生成;B不正确,氨水是弱碱,应该用化学式表示;C不正确,CO2过量,生成的是碳酸氢钠,答案选D。
点评:该题是高考中的高频题,属于中等难度的试题,试题侧重考查学生的能力,有助于培养学生的应试能力。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式。
本题难度:简单
2、选择题 下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+
B.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑
C.将氯气溶于NaOH溶液制备漂白粉:Cl2+2OH-=H2O+Cl-+ClO-
D.用稀硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
参考答案:D
本题解析:
试题分析:A没有配平,不符合电子守恒、电荷守恒.应写成:Cu+2Fe3+=2 Cu2++Fe2+。错误。B没有配平,不符合电子守恒、电荷守恒.应写成:2Na2O2+2 H2O=4Na++4OH-+O2↑.C制取漂白粉是用氯气与石灰乳反应,而并非是NaOH溶液。错误。D H2O2具有还原性, KMnO4溶液有强氧化性,在酸性环境中氧化性会增强。可以利用二者发生的氧化还原反应放出氧气来证明H2O2的还原性。正确。
本题难度:一般
3、选择题 下列离子方程式书写正确的是:
A.氯化铝溶液和过量的氨水反应:Al3++4NH3·H2O=AlO2-+4NH4+
B.少量的CO2通入NaOH溶液中:CO2+2OH-=CO32-+H2O
C.醋酸加入小苏打溶液中:HCO3-+H+=CO2↑+H2O
D.硫化钠的水解:S2-+2H2O H2S+2OH-
H2S+2OH-
参考答案:B
本题解析:
试题分析:A、氯化铝溶液和过量的氨水反应生成Al(OH)3,错误;B、少量的CO2通入NaOH溶液生成Na2CO3和H2O,离子方程式为:CO2+2OH-=CO32-+H2O,正确;C、醋酸为弱酸,不能拆成H+,错误;D、S2?分别水解:S2?+H2O 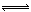 HS?+OH?,错误。
HS?+OH?,错误。
本题难度:一般
4、选择题 在Fe+2Fe3+=3Fe2+的离子反应中,Fe3+代表的化合物不可以是( )
①Fe(OH)3②FeCl3③Fe2(SO4)3④Fe(SCN)3.
A.①③④
B.①③
C.①④
D.①
参考答案:Fe+2Fe3+=3Fe2+的离子反应中,Fe3+代表②Fe
本题解析:
本题难度:简单
5、选择题 下列离子方程式正确的是???(????)
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2+ + 2OH-+ 2H+ + SO42-= BaSO4↓ + 2H2O
B.向100mL 0.1mol/L FeBr2溶液中通入0.01mol的Cl2:2Fe2+ + 4Br-+ 3Cl2 = 2Fe3+ + 2Br2 + 6Cl-
C.AlCl3溶液与过量氨水混合:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.向Mg(HCO3)2中加足量的Ca(OH)2溶液:Ca2+ +2OH-+2HCO3-+2Mg2+=CaCO3↓+MgCO3↓+2H2O
参考答案:C
本题解析:
试题分析:A中生成物还有一水合氨,A不正确;B中亚铁离子的还原性强于溴离子,则氯气首先氧化的是亚铁离子,然后再氧化溴离子。溴化亚铁的物质的量是0.01mol,而氯气只有0.01mol,所以溴离子剩余,B不正确;D中氢氧化钙过量,生成物是碳酸钙、氢氧化镁和水,D不正确,答案选C。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4
本题难度:一般