微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)如图所示,试管中集满干燥的氯气,胶头滴管中装有供反应的足量浓氨水.滴入浓氨水,开始时试管内发生的反应有氧化还原反应:NH3+Cl2→N2+HCl并产生红光和白烟。

请根据以上反应和现象回答下列问题:?
(1)标志反应全部完成的现象是______.
(2)反应完毕后,将试管浸入水中并倒立着试管,取下滴管,有水进入试管,在室温时,进入试管内的水约占试管容积的______。
(3)反应中生成的白烟是______。
(4)用写出试管中反应的化学方程式________。
参考答案:(1)不再产生红光和白烟(2)2/3(3)NH4Cl(4)8
本题解析:由题意知因发生反应8NH3+3Cl2=6NH4Cl+N2时放出大量的热而产生红光和白烟.当不再产生红光和白烟时表明不再放出大量的热,此时反应已经完成.由反应方程式可知,反应产生的N2为参加反应的Cl2的物质的量的(1/3),故进入试管的水的体积约为试管容积的(2/3).显然白烟为NH4Cl。
本题难度:简单
2、选择题 常温下能在浓HNO3中溶解的金属是(???)
A.Al
B.Ag
C.Fe
D.Pt
参考答案:B
本题解析:由于Al、Fe在常温下遇浓HNO3会产生钝化现象,Pt不溶于HNO3,只溶于王水,因此只有Ag可以溶解。
本题难度:简单
3、计算题 (6分)有一硫酸与硝酸的混合溶液,取出10ml加入足量BaCl2溶液,过滤、洗涤、烘干后得到4.66g沉淀;滤液与4.0mol/LNaOH溶液反应用去20ml碱液时,恰好完全中和。
试求:
(1)原混和液中H2SO4、HNO3的物质的量浓度各为多少?
(2)另取10ml原混和液, 加入2.56g铜粉共热时,若只产生NO气体,则在标准状况下收集到的气体体积为多少mL?
加入2.56g铜粉共热时,若只产生NO气体,则在标准状况下收集到的气体体积为多少mL?
参考答案:(6分)(1)c(H2SO4)=2mol/L (2分)???
本题解析:略
本题难度:一般
4、选择题 下列结论正确的是( )?
A.酸性:H2SO4>HClO4>H2SO3?
B.酸性:HClO4>H2SO4>H2SO3?
C.氢化物的稳定性:HF>HCl>H2S>H2Te?
D.氢化物的稳定性:HF>H2S>HCl>H2Te?
参考答案:BC
本题解析:S和Cl具有相同的电子层数,非金属性Cl>S,所以酸性HClO4>H2SO4。又因为H2SO4是强酸,H2SO3是中强酸,所以酸性H2SO4>H2SO3,则B项正确。F和Cl同主族,核电荷数F<Cl,非金属性F>Cl,S和Te相比,非金属性S>Te,所以综合起来,非金属性:F>Cl>S>Te,则气态氢化物的稳定性:HF>HCl>H2S>H2Te。C项正确。
本题难度:简单
5、填空题 已知:Fe2+能被稀硝酸氧化,反应方程式为:3Fe(NO3)2+4HNO3(稀)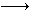 3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
硝酸体积(mL)
| 100
| 200
| 300
| 400
|
剩余固体(g)
| 18.0
| 9.6
| 0
| 0
|
放出气体的体积(mL)
| 2240
| 4480
| 6720
| ?
(1)由NO与HNO3的关系可知,稀硝酸的物质的量浓度为_______ mol·L-1。
(2)稀硝酸的密度为__________g/cm3。
(3)放出2240 mL气体时,反应的离子方程式是_____________________________,放出4480 mL气体时,消耗金属的质量为_______g。
(4)原混合物中铁和铜的物质的量比为__________。
(5)加入400 mL稀硝酸,反应完全后,溶液中NO3-的物质的量为________mol。
(6)当溶液中Cu2+、Fe2+的物质的量浓度相等时,放出气体的体积_________mL(标准状况下)。
参考答案:(本题共16分)
(1)? 4??(2分)?(2)?
本题解析:略
本题难度:困难
|