微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是(设阿伏加德罗常数的数值为6.02×1023)(??? )。
A.在标准状况下,22.4 L苯所含分子数目为6.02×1023
B.1 mol/L K2SO4溶液所含K+数目为2×6.02×1023
C.在常温常压下,16 g 02和03的混合气体所含原子数目为6.02×1023
D.2.4 g Mg与足量盐酸完全反应时,失去电子数目为O.1x 6.02×1023
参考答案:C
本题解析:A:标准状况下苯为液体,不符合气体的摩尔体积,不正确
B:溶液没有体积,无法计算其中的微粒数目,不正确
C:混合气体均由氧元素组成,故16 g混合气体含有的氧原子一定为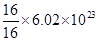 个,正确
个,正确
D:由Mg-2e-=Mg2+可知,2.4 g Mg与足量盐酸完全反应时,失去电子数目为 本题难度:一般
本题难度:一般
2、填空题 在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1L “鲜花保鲜剂”中含有的成分,阅读后回答下列问题
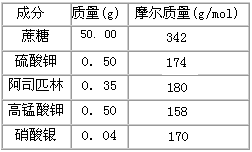
(1)上述“鲜花保鲜剂”的成分中,硫酸钾的物质的量浓度为________(保留小数点后三位)。
(2)配制上述1L“鲜花保鲜剂”所需的仪器有:量筒、烧杯、玻 璃棒、托盘天平、药匙、________、
________。(在横线上 填写所缺仪器的名称)
(3)在溶液配制过程中,下列操作对配制结果没有影响的是_________。
A.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶刻度线,又加水至溶液凹液面最低处与刻度线相切
参考答案:(1)0. 003mol/L
(2)1000mL容量
本题解析:
本题难度:一般
3、填空题 0.2mol NH3 质量为________,在标准状况下的体积为_______,所含氢原子的物质的量为_______,将其溶于水配制成1L溶液,所得溶液中溶质的物质的量浓度为________。
参考答案:3.4g;4.48L;0.6mol;0.2mol/L
本题解析:
本题难度:简单
4、选择题 下列叙述正确的是(??)
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1 L一氧化碳气体的质量一定比1 L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数目一定相等
参考答案:B
本题解析:同温同压下,相同体积的气体,物质的量才相等,A不正确;未注明气体所处的温度和压强,无法判断,C不正确;强酸的元数不一定相等,D不正确。
本题难度:一般
5、计算题 (7分)向120mL浓硫酸中加入64g铜片,加热一段时间后至不再反应为止。
(1)在标准状况下,测得反应中共生成SO216.8L,计算被还原的硫酸的物质的量是多少?
(2)将反应后的混合物加水稀释到200mL并除去不溶物,加入足量的锌粉,放出9.408L氢气(标准状况下),计算原浓硫酸的物质的量浓度为多少?
参考答案:(1)0.75mol(3分)(2)16mol/L(4分)
本题解析:
试题分析:首先写出所涉及的化学反应方程式:
Cu + 2H2SO4(浓) = CuSO4 + SO2↑ + H2O①
Zn + CuSO4 = ZnSO4 + Cu ②
Zn + H2SO4 = ZnSO4 + H2↑ ③
(1)SO216.8L的物质的量为0.75mol,依据反应方程式①可计算参加反应的硫酸的物质的量为1.5mol,被还原的硫酸应等于二氧化硫的物质的量0.75mol。
(2)依据综合信息可知,硫酸反应后产物有SO2,ZnSO4等产物,依据硫元素守恒计
本题难度:一般