微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4,③CH3COOH,④NH4Cl ⑤NaOH,由水电离出的C(H+)大小关系正确的是
A.④>③>①=⑤>②
B.①=②>③>④>⑤
C.②>①>③>④>⑤
D.④>③>①>⑤>②
参考答案:A
本题解析:试题分析:水是弱电解质,存在电离平衡H2O H++OH-。因此酸或碱都是抑制水的电离,而某些发生水解的盐可以促进水的电离。且氢离子或OH-浓度相等时,对水的电离平衡是等效的。由于盐酸、硫酸、氢氧化钠是强碱,醋酸是弱酸,氯化铵水解,因此由水电离出的C(H+)大小关系是④>③>①=⑤>②,答案选A。
H++OH-。因此酸或碱都是抑制水的电离,而某些发生水解的盐可以促进水的电离。且氢离子或OH-浓度相等时,对水的电离平衡是等效的。由于盐酸、硫酸、氢氧化钠是强碱,醋酸是弱酸,氯化铵水解,因此由水电离出的C(H+)大小关系是④>③>①=⑤>②,答案选A。
考点:考查弱电解质的电离及盐类水解等
点评:外界条件对电离平衡的影响,也遵循勒夏特例原理,据此可以进行有关的判断。
本题难度:简单
2、选择题 下列说法中,正确的是
A.△H>0表示放热反应,△H<0表示吸热反应
B.M与N是同素异形体,由M=N;△H=+119KJ/mol可知,M比N稳定
C.lmol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
参考答案:B
本题解析:△H<0表示放热反应,△H>0表示吸热反应,选项A不正确;中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以选项C不正确;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,因此选项D不正确,答案选B。
本题难度:简单
3、选择题 下列化学应用中不涉及氧化还原反应的是( )
A.工业上由硅的氧化物制备硅单质
B.生活中使用明矾净水,除去水中悬浮的微小颗粒
C.漂白粉用作疫区的环境消毒
D.过氧化钠用作呼吸面具的供氧剂
参考答案:B
本题解析:
试题分析:A.由硅的氧化物制备硅单质,Si元素的化合价降低,发生氧化还原反应,故A不选;B.明矾净水,铝离子水解生成胶体,没有元素的化合价变化,不发生氧化还原反应,故B选;C.漂白粉用作疫区的环境消毒,利用漂白粉的强氧化性,涉及氧化还原反应,故C不选;D.过氧化钠用作呼吸面具的供氧剂,反应生成氧气,过氧化钠中O元素的化合价变化,发生氧化还原反应,故D不选;故选B。
考点:考查氧化还原反应判断
本题难度:一般
4、选择题 下列现象与氧化还原反应无关的是
A.铜币上长铜绿[Cu2(OH)2CO3]
B.含Fe2+的补血药丸需用糖衣包裹
C.大理石板被食醋腐蚀
D.酸雨在前一段时间内pH减小
参考答案:C
本题解析:考查氧化还原反应的概念:只要有化合价的改变就属于氧化还原反应
A:铜被氧化为Cu2(OH)2CO3
B:Fe2+在空气中易被氧化为Fe3+,故需密封保存
C:碳酸钙与醋酸发生的为复分解反应,非氧化还原反应
D:酸雨成分之一亚硫酸,可被氧氧气氧化为强酸硫酸,酸性增强,pH减小
答案为C
本题难度:简单
5、填空题 (8分)
(1)写出下列反应的离子方程式
①Ca(HCO3)2与过量的NaOH溶液的反应:
②CH3COOH溶 液与NaOH溶液反应:
(2)写出下列反应的离子方程式,并在离子方程式中用“单线桥”表示电子转移的方向和数目:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
如果此反应生成了5molCl2,发生氧化反应的HCl的物质的量为 mol。
参考答案:(1)①Ca2++2HCO3-+2OH-=CaCO3↓+2H
本题解析:
试题分析:(1)①Ca(HCO3)2与过量的NaOH溶液的反应的离子反应为Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故答案为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-;②CH3COOH溶液与NaOH溶液反应的离子反应为CH3COOH+OH-=CH3COO-+H2O,故答案为:CH3COOH+OH-=CH3COO-+H2O.(2)根据离子方程式的书写方法,得到反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,应的氧化剂是高锰酸钾,还原剂是盐酸,在反应的16mol盐酸中,只有10mol做还原剂,被氧化、发生氧化反应,同时转移电子是10mol,用单线桥表示反应中电子转移的方向和数目为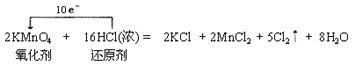 ,此反应生成了5molCl2,发生氧化反应的HCl的物质的量为10mol,故答案为:
,此反应生成了5molCl2,发生氧化反应的HCl的物质的量为10mol,故答案为:
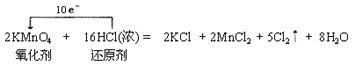 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;10.
2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;10.
考点:离子反应方程式书写、氧化还原反应
本题难度:一般