微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有机物的命名正确的是
A.3
B.3-二甲基丁烷
C.3-甲基-2-乙基戊烷
D.3-甲基-1-戊烯
E.2
F.3-二甲基戊烯
参考答案:C
本题解析:试题分析:烷烃的命名原则是:找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙...)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷;从最近的取代基位置编号:1、2、3...(使取代基的位置数字越小越好)。以数字代表取代基的位置。数字与中文数字之间以- 隔开;有多个取代基时,以取代基数字最小且最长的碳链当主链,并依甲基、乙基、丙基的顺序列出所有取代基;有两个以上的取代基相同时,在取代基前面加入中文数字:一、二、三...,如:二甲基,其位置以 , 隔开,一起列于取代基前面。如果含有官能团,则含有官能团的最长碳链作主链,编号也是从离官能团最近的一端开始,据此可知选项C正确。A应该是2,2-二甲基丁烷。B应该是3,4—二甲基己烷,D中没有指明双键的位置,答案选C。
考点:考查有机物的命名
点评:该题是基础性试题的考查,侧重对学生基础知识的检验和训练。该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可。有利于培养学生的规范答题能力。
本题难度:一般
2、选择题 根据以下反应 ,
, 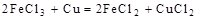 , 判断:
, 判断:  氧化性强弱的顺序是
氧化性强弱的顺序是
A.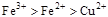
B.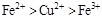
C.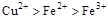
D.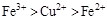
参考答案:D
本题解析:该题利用氧化性的强弱顺序:氧化剂>氧化产物;
分析第一个反应:CuCl2是氧化剂(铜由+2价降低到0价,被还原),FeCl2是氧化产物(铁由0价升高到+2价,被氧化);分析第二个反应:FeCl3是氧化剂(铁由+3价降低到+2价,被还原),CuCl2是氧化产物(铜由0价升高到+2价,被氧化);故选D
本题难度:一般
3、选择题 pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法不正确的是
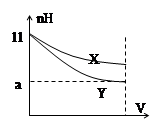
A.X、Y两种碱的物质的量浓度一定相等
B.稀释后,X溶液碱性比Y溶液碱性强
C.若9D.完全中和X、Y两溶液时,消耗同浓度盐酸的体积V(X)>V(Y)
参考答案:A
本题解析:试题分析:根据稀释后pH的变化可以判断X是弱碱,Y是强碱,所以pH相同的强碱和弱碱弱碱的物质的量浓度大,A错误,其余选项均正确,答案选A。
考点:弱电解质的电离
点评:强碱和弱碱稀释相同倍数时,由于弱电解质存在电离平衡,所以pH变化小,强电解质不存在电离平衡,pH变化大。
本题难度:简单
4、选择题 以石墨为电极,电解500?mL?NaCl溶液,当两极产生气体总体积为16.8?mL时(标准状况),溶液的pH范围是
A.5~6
B.7~8
C.8~10
D.10~12
参考答案:D
本题解析:
本题难度:一般
5、选择题 假定把12C的相对原子质量定为24,把24g12C含有的原子个数定为阿伏加德罗常数,而物质的量的概念不变。则下列推断不正确的是…………
A.此时16O的相对原子质量为32
B.标况下44g CO2的体积为22.4L
C.NA个氧分子与NA个氢分子有相同数目的分子
D.44g CO2和28g CO含有相同数目的分子
E.标况下,1mol O2为44.8L
F.40g NaOH溶于水配成1L溶液,其物质的量浓度为1mol·L-1
参考答案:F
本题解析::本题考查的知识点是:对物质的量、相对原子质量、阿伏加德罗常数、摩尔质量、气体摩尔体积、质量、体积等一系列概念的理解。解答本题时可将一系列物理量分为两大类,即客观的,如质量、体积、微粒数、密度等,它们不随人为规定而改变;另一类为主观的,如物质的量、阿伏加德罗常数、气体摩尔体积、摩尔质量、原子量、分子量等均为人为规定,它们随人为规定的改变而改变。而且原子量的标准改变会使原子量和分子量的数值改变,而阿伏加德罗常数标准的改变会引起物质的量、摩尔质量、气体摩尔体积、物质的量浓度及阿伏加德罗常数的数值发生改变。
----本题中原子量的标准的改变实际上是将原子量的标准由12C原子质量的1/12变为12C原子质量的1/24。所以将12C的原子量定为24时,物质的式量加倍。而将阿伏加德罗常数由12g12C所含碳原子数变为24g12C所含原子个数。所以摩尔质量、气体摩尔体积都应加倍,而物质的量及物质的量浓度均随之发生变化。
----具体分析如下:
A、正确,氧原子的实际质量没变,但标准却由12C质量的1/12变为1/24,所以16O的原子量由16变为32
B、正确,44gCO2客观存在,其标况下的体积22.4L也客观存在
C、正确,此时NA虽然由原来的约6.02×1023变为约12.04×1023,但对氧分子和氢分子而言,这种变化是一致的
D、正确,理由同C
E、正确,虽然氧气的体积是客观存在的,32g的体积就是22.4L,64g的体积就是44.8L,但此时32g和64g谁是1mol呢?务必注意到“标准”的改变,显然此时的64g氧气才是1mol,体积44.8L
F、不正确,由于“标准”的改变,此时的40gNaOH已经不是1mol了, 而是0.5mol!!则,所得溶液的物质的量浓度为0.5mol·L-1
本题难度:一般