微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是
A.酸性强弱:HIO4>HBrO4>HClO4?????????????
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH??????????????
D.金属性强弱:Na>Mg>Al
参考答案:A
本题解析:非金属性越强,最高价氧化物的水化物的酸性越强,A中都是第ⅦA元素,自上而下非金属性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱,所以A不正确。其余都是正确的,答案选A。
本题难度:简单
2、选择题 具有下列电子排布式的原子中,半径最小的是
A.ls22s22p63s23p3
B.1s22s22p3
C.1s22s2sp2
D.1s22s22p63s23p4
参考答案:B
本题解析:同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大。根据构造原理可知A、B、C、D分别是P、N、C、Si,所以原子半径最小的是N,即答案B正确。
本题难度:简单
3、选择题 下列化合物中,只存在共价键的是
A.H2O
B.KCl
C.NaOH
D.Na2O2
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是
A.金属钠
B.溴水
C.碳酸钠溶液
D.新制Cu(OH)2悬浊液
参考答案:C
本题解析:
本题难度:困难
5、选择题 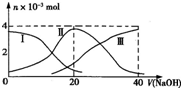 常温下,向20mL?0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表
常温下,向20mL?0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表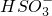 、Ⅲ代表
、Ⅲ代表 ).根据图示下列判断正确的是
).根据图示下列判断正确的是
A.当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-12??
B.当V(NaOH)=20?mL时:c(Na+)>c()>c(H+)>c()>c(OH-)
C.当V(NaOH)=40?mL时2c(Na+)=c()
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,溶液的温度会继续升高
参考答案:B
本题解析:分析:A.当V(NaOH)=0时,酸电离生成的c(H+)>2×10-3mol/L,由水电离出的c(H+)水=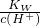 ;
;
B.当V(NaOH)=20?mL时,发生反应为NaOH+H2SO3=NaHSO3+H2O,溶液主要为NaHSO3,电离为主,溶液显酸性;
C.当V(NaOH)=40?mL时,由图象可知,溶质为Na2SO3,以水解为主;
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,不再发生化学反应.
解答:A.当V(NaOH)=0时,由图象可知,酸电离生成的c(H+)>2×10-3mol/L,由水电离出的c(H+)水=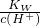 ≠1.0×10-12mol/L,故A错误;
≠1.0×10-12mol/L,故A错误;
B.当V(NaOH)=20?mL时,发生反应为NaOH+H2SO3=NaHSO3+H2O,溶液主要为NaHSO3,HSO3-电离大于水解,溶液显酸性,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故B正确;
C.当V(NaOH)=40?mL时,由图象可知,溶质为Na2SO3,以水解为主,则c(Na+)>2c(SO32-),故C错误;
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,不再发生化学反应,所以温度变化不明显,不会继续升高,故D错误;
故选B.
点评:本题考查离子反应,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图中分析即可,不需要进行计算,题目难度中等.
本题难度:困难