微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中,在标准状况下体积最大的是
A.900g H2O
B.71g Cl2
C.48g O2
D.28g N2
参考答案:C
本题解析:试题分析:A、水在标准状况下为液体,900gH2O的体积为0.9L;B、Cl2的物质的量为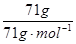 ?=1mol,22.4L;C、O2的物质的量为
?=1mol,22.4L;C、O2的物质的量为 ?=1.5mol,D、N2的物质的量为
?=1.5mol,D、N2的物质的量为 ?=1mol;显然C的物质的量最大,其体积最大为1.5mol×22.4L·mol-1=33.6L,选C.
?=1mol;显然C的物质的量最大,其体积最大为1.5mol×22.4L·mol-1=33.6L,选C.
考点:物质的量的相关计算;气体摩尔体积
本题难度:简单
2、选择题 下列反应中,既属于氧化还原反应同时又是放热反应的是
A.酸碱中和反应
B.Ba(OH)2.8H2O与NH4Cl
C.灼热的炭与CO2反应
D.甲烷与O2的燃烧反应
参考答案:D
本题解析:试题分析:首先判断哪些属于氧化还原反应:C项 和D项。放热反应的有A、D,故既属于氧化还原反应同时又是放热反应的是D项,答案选D。
考点:氧化还原反应和放热反应的判断
点评:本题综合考查氧化还原反应知识和化学反应的能量变化的判断,属于基础题,侧重培养学生的判断能力。
本题难度:困难
3、选择题 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是?
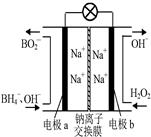
A.电池放电时Na+从b极区移向a极区
B.每消耗3 mol H2O2,转移的电子为3mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O
参考答案:D
本题解析:试题分析:以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,然后再结合原电池的工作原理和解答该题。
A.原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,故A不正确;
B.正极电极反应式为H2O2+2e-=2OH-,每消耗3molH2O2,转移的电子为6mol,故B错误;
C.电极b采用MnO2为正极,H2O2发生还原反应,得到电子被还原生成OH-,MnO2既作电极材料又有催化作用,故C不正确;
D.负极发生氧化反应生成BO2-,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故D正确,答案选D。
考点:考查原电池工作原理
点评:该题是中等难度的试题,试题综合性强。主要是考查学生对电解原理的熟悉了解程度,本题涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,注意从化合价的变化分析和判断。
本题难度:简单
4、选择题 从氧化还原角度分析,下列反应中水的作用相同的是
① 铁和水蒸气反应 ② 过氧化钠和水反应
③氯气和水反应 ④ 二氧化氮和水反应3NO2+H2O=2HNO3+NO
A.①②③
B.①②④
C.②③④
D.①③④
参考答案:C
本题解析:
试题分析:A:3Fe+4H2O  Fe3O4+4H2↑;B:2Na2O2+2H2O=NaOH+O2↑,过氧根中的氧呈-1价,是中间价态,所以过氧化钠即有氧化性又有还原性,与水反应发生的是氧化还原反应;C:Cl2+H2O=HCl+HClO,氯元素的化合价有升有降,是氧化还原反应;D:3NO2+H2O=2HNO3+NO,是氧化还原反应,故选C
Fe3O4+4H2↑;B:2Na2O2+2H2O=NaOH+O2↑,过氧根中的氧呈-1价,是中间价态,所以过氧化钠即有氧化性又有还原性,与水反应发生的是氧化还原反应;C:Cl2+H2O=HCl+HClO,氯元素的化合价有升有降,是氧化还原反应;D:3NO2+H2O=2HNO3+NO,是氧化还原反应,故选C
考点:氧化还原反应
点评:正确写出化学方程式是解本题的关键,难度不大
本题难度:一般
5、选择题 标准状况下,往100mL 0.2mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是
A.0.224L
B.0.336L
C.0.448L
D.0.672L
参考答案:C
本题解析:错解分析:忽略离子还原性强弱。在氧化还原反应中,还原性(氧化性)越强的物质(或微粒)优先参与氧化还原反应。由于2Br- + Cl2=Br2 + 2Cl-,根据题意,有50 %的Br-被氧化,即有0.02mol被氧化,因此通入的氯气的体积为0.224L。错选A。
正解:由于Fe2+还原性比Br-强,当往FeBr2中通入氯气,发生的反应依次为:1)Cl2+2Fe2+=2Cl—+2Fe3+;2)Cl2+2Br—=2Cl—+Br2。因此溶液反应中反应的情况应该是:Fe2+被完全氧化并有50% Br— 被氧化。根据电子得失关系,Fe2+、Br—离子失去的电子总数(0.02mol+0.02mol=0.04mol)等于Cl2得到的电子总数。由于每个Cl2在反应中得到2个电子,因此Cl2的物质的量为0.02mol,其体积为0.448L。本题正确答案为C。(注:分析多种离子共存的溶液体系的电解问题时,也必须考虑离子反应次序——对于氧化性或还原性越强的离子,电解过程中一般优先放电。)
本题难度:简单