微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组化合物中化学键类型不同的是[???? ]
A.NaCl和HNO3
B.H2O和NH3
C.CaF2和 CsCl
D.CCl4和N2O
参考答案:A
本题解析:
本题难度:简单
2、选择题 SiCl4的分子结构与CCl4类似,对其作出如下推断:①常温常压下SiCl4是分子晶体;②常温常压下SiCl4是液体;③SiCl4是由共价键形成的分子;④SiCl4熔点高于CCl4。其中正确的是()
A?只有①②④??? B?只有①②③??? C?只有②③④??? D?①②③④
参考答案:C
本题解析:常温常压下CCl4是液体,①不正确,②正确。CCl4是由极性键构成的共价化合物,③正确。SiCl4和CCl4形成的晶体均属于分子晶体,其熔沸点和分子间作用力有关,相对分子质量越大,分子间作用力越强,熔沸点越高,④正确。答案选C。
本题难度:一般
3、计算题 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为2Al(OH)3+12HF+3A =2Na3AlFs+3CO2 +9H2O。
(1)熔融晶体A时痛要破坏的作用力是??,冰晶石中的配位体是??????。
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为????????????????,该分子的空间构型为????????????。
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小:?????????????;写出含有其中电负性较小元素的原子,且形成的分子的空间构型呈“V”形的物质的化学式(单质和化合物各写一种)????????????????、?????????????????。
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为?????????。若晶胞的边长为a nm,则合金的密度为??????g? cm-3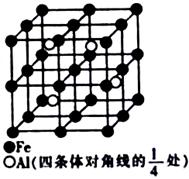
参考答案:
(1)离子键;F-??????(2)sp;直线型
本题解析:
试题分析:(1)根据原子守恒可知A为Na2CO3,属于离子化合物,反应中会破坏离子键。Na3AlF6中AlF6-是配离子,Al是中心原子,F-为配位体。
(2)CO2是非极性分子,中心原子C的轨道杂化方式为sp,分子构型是直线型。
(3)相邻的两种元素是F和O,F的电负性较大,非金属性强,F2可将水中的氧置换出来。含有O且分子构型是“V”型的分子有H2O、SO2、O3等。
(4)晶胞中含有铁原子个数为 本题难度:一般
本题难度:一般
4、选择题 下列分子中,以极性键结合的非极性分子是
[ ??? ]
A. N2
B. CO2
C. H2O
D. NH3
参考答案:B
本题解析:
本题难度:简单
5、选择题 【南海中学2008届高三化学第一次月考】将下列物质分别加到溴水中,振荡后,因发生化学变化而使溴水褪色的是:①硫化钠②氢氧化钠③乙酸④镁粉⑤裂化汽油⑥甲苯
A.①②③⑤
B.②④⑤⑥
C.①②④⑤
D.②③④⑤
参考答案:C
本题解析:硫化钠可以被溴水氧化;氢氧化钠和溴水反应生成无色的盐溶液;镁粉和溴水生成MgBr2;裂化汽油含有烯烃,可以和溴水加成。
本题难度:一般