微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法正确的是
A.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液
B.催化剂可以加快化学反应速率但不能改变化学反应的焓变
C.100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱
D.对于反应2SO2(g)+O2(g)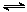 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
参考答案:BC
本题解析:
试题分析:A. NaOH在空气中易变质,不可能得到NaOH标准溶液,错误;B正确;C.HB放出的氢气多,说明其中含有较多的未电离的分子,说明HB酸性比HA弱,正确;D.平衡常数K只与温度有关,不会受压强的影响,错误;
本题难度:一般
2、选择题 在容积可变的密闭容器中存在如下反应:2A(g)+B(g) 3C(g)? ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是(???? )
3C(g)? ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是(???? )
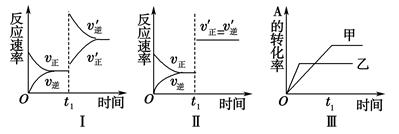
A.图Ⅰ表示的是t1时刻升高温度对反应速率的影响
B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
参考答案:AC
本题解析:
试题分析:已知反应的正反应为放热反应,所以升高温度正逆反应速率均增大,平衡逆向移动,所以v逆>v正,所以A正确;由于反应前后气体系数不变,所以造成图Ⅱ中正逆反应速率同等程度增大的因素可以是加入催化剂,也可以是增大压强,B错误;根据先拐先平数值大的规律,图Ⅲ中曲线乙先达拐点,乙的温度高,且温度升高平衡左移,A的转化率降低,所以C正确;催化剂不能改变平衡,所以D错误;故选AC。
本题难度:一般
3、填空题 (13分)
已知T1时反应H2(g)+I2(g) 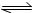 2HI(g)?;??△H=-9.4 kJ/mol?
2HI(g)?;??△H=-9.4 kJ/mol?
(1)T1时,将2?mol HI(g)通入容积为2L的容器中发生上述反应,测得T1温度时各物质的物质的量随时间的变化关系如下表:
t(min)
?
n(mol)
?
  ?物质 ?物质
0
| 2
| 4
| 6
| 8
| 10
| H2
| 0
| 0.174
| 0.224
| 0.244
| 0.244
| 0.244
| I2
| 0
| 0.174
| 0.224
| 0.244
| 0.244
| 0.244
| HI
| 2
| 1.652
| 1.552
| 1.512
| 1.512
| 1.512
①前4 min,用HI(g)表示该反应的平均速率为????????????????;
②T1温度下,此反应H2(g)+I2(g) 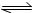 2HI(g)?的平衡常数表达式为????????????????; 2HI(g)?的平衡常数表达式为????????????????;
③10分钟后,要使HI的转化率变为10%,可能的操作是??????????????????????;
A.扩大容积????????????????? B.同时减少三种物质各0.01 mol
C.加入HI(g) 1 mol???????????? D.降低温度
(2)如图,将2 mol HI(g)和2 molBr2(g)分别通入用光滑的滑动隔板隔离的同一容器的两边。加热容器升温至T2 ,反应足够长时间后,有关说法正确的是???????????。
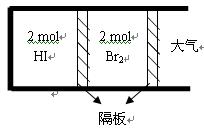
A.两边气体体积相同
B.两边气体颜色均比加热前变深
C.两边气体的平均相对分子质量均比加热前大
D.两边气体密度均比加热前减小
参考答案:
(1)①0.056 mol/(L ·min)(3分)
本题解析:略
本题难度:一般
4、选择题 在一定温度下,反应:2A(s)+2B(g)?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
A.容器内的压强不随时间而变化
B.混合气体的密度不再随时间而变化
C.A的质量不再改变
D.平衡混合气体的平均相对分子质量不再改变
参考答案:A.由方程式可以看出,反应前后气体的物质的量相等,无论是否达
本题解析:
本题难度:简单
5、选择题 下列关于化学反应限度的叙述中正确的是( )
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体压强不再改变时,该反应一定达到反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
参考答案:A、改变影响化学平衡的条件,化学平衡被破坏,平衡移动,即改变
本题解析:
本题难度:简单
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|
|