?
参考答案:(共10分)
(1)分液漏斗(1分);?? B(1分)
本题解析:本题从温度和浓度两方面来探究制取氯酸钠、次氯酸钠的生成过程;
(1)首先涉及到制取氯气:一般用饱和食盐水除氯化氢气体,浓硫酸干燥氯气,凡是能和氯气反应的物质均不能用来除杂质;
(2)在讨论氯气的性质时,重点考查了氯水的成份及其氧化性。
本题难度:一般
3、填空题 1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18 g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水)。请填写下列空白:

(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易发生副反应。请写出乙醇发生消去反应的方程式?????。
(2)写出制备1,2-二溴乙烷的化学方程式:??????????????????????????????????????。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请回答发生堵塞时瓶b中的现象:??????????????????????????????????????。
(4)容器c中NaOH溶液的作用是:????????????????????????????????。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因_______________。
参考答案:(10分,每空2分)(1)CH3CH2OH
本题解析:
试题分析:(1)乙醇发生消去反应生成乙烯,所以反应的化学方程式是CH3CH2OH CH2=CH2↑+H2O。 CH2=CH2↑+H2O。
(2)乙烯和溴水发生加成反应即可生成1,2-二溴乙烷,反应的化学方程式是CH2=CH2+Br2 → CH2BrCH2Br。
(3)如果d中发生堵塞,则b中压强必然增大,从而b中水面会下降,玻璃管中的水面会上升,甚至溢出。
(4)由于浓硫酸具有强氧化性,能把乙醇氧化生成SO2和CO2,从而干扰实验,所以容器c中NaOH溶液的作用是除去乙烯中带出的酸性气体或答二氧化碳、二氧化硫。
(5)一方面由于乙烯发生(或通过液溴)速度过快,导致部分乙烯没有完全被吸收。其次实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃,有副反应发生。
点评:该题是高考中的常见题型,属于中等难度的试题,侧重对实验设计和动手操作能力的培养。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
4、实验题 (本题共12分)
氯气和氯乙烯都是重要的化工产品,年产量均在107t左右。氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要_________、________(填写试剂或溶液名称)
(2)实验室用2.00mol/L的盐酸和漂粉精[成分为Ca(ClO)2、CaCl2]反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为_________m,l。
(3)实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
_________________
4)工业上用电石-乙炔法生产乙烯的反应如下:
CaO+3C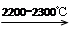 CaC2+CO CaC2+CO
CaC2+2H2O→HC≡CH↑+Ca(OH)2
HC≡CH↑+HCl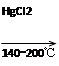 CH2=CHCl CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是___________________、_____________________。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
___________________________________
参考答案:(1)饱和氯化钠溶液、氢氧化钠溶液?? (2)100
本题解析:
试题分析:(1)浓盐酸易挥发,生成的氯气中含有氯化氢,应该用饱和氯化钠溶液除去;氯气有毒需要尾气处理,用氢氧化钠溶液吸收。
(2)根据反应物和生成物可知,反应的化学方程式为 4HCl+Ca(ClO)2→CaCl2+2H2O+2Cl2↑,反应中生成氯气的物质的量是0.1mol,则消耗氯化氢的物质的量是0.2mol,盐酸的浓度是2.00mol/L,因此需要盐酸的溶液的体积是100ml。
(3)氯气能与氢氧化钠溶液完全反应,而空气与氢氧化钠不反应,据此检验,即试管收集氯气,收集满后讲试管倒立在氢氧化钠溶液中,观察试管内有无残留气体。
(4)根据流程可知,反应需要高温,因此缺点之一是高能耗;需要氯化汞作催化剂,汞是重金属,因此缺点之二是会污染环境。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢,产生的氯化氢可以与乙炔反应又生成氯乙烯,因此方案为CH2=CH2+Cl2→ClCH2CH2Cl、ClCH2CH2Cl→CH2=CHCl+HCl、HC≡CH+HCl→CH2=CHCl。
本题难度:一般
5、选择题 如图是制备和收集气体的实验装置,该装置可用于(?)
 ? ?
A.浓硝酸与铜反应制取二氧化氮
B.过氧化氢与二氧化锰反应制取氧气
C.浓氨水和生石灰反应制取氨气
D.浓盐酸和二氧化锰反应制取氯气
参考答案:B
本题解析:由装置图可以看出该反应不需要加热,生成的气体难溶于水,且不与水反应,所以只有选项B正确。答案选B。
本题难度:一般
|