微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某学生为探究钠与CO2的反应,利用如下装置进行实验。
(已知PdCl2能被CO还原得到黑色的Pd)
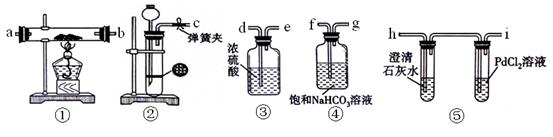
(1)请将上图各装置连接完整
???????接??????, ???????接??????, ???????接??????, ???????接??????。
(2)装置②制备CO2时具有随开随用,随关随停的功能。简述该装置随关随停的理由
?????????????????????????????????????????????????????????????????????;
(3)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是??????????????。
A.NaNO3溶液
B.CCl4
C.苯
D.稀硝酸
(4)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是?????????????????
?????????????????????,当观察到???????????????????????????????????????现象时才点燃酒精灯。此步操作的目的是????????????????????????????????????????????。
(5)反应过程中CO2足量,假如反应过程中有下列两种情况,分别写出两种情况下钠与CO2反应的化学方程式。
①装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体。???????????????????????????????????????。
②装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,且溶液中还有固体残留。????????????????????????。
参考答案:(1)c接f,g接d,e接a(b),b(a)接h(3分)
本题解析:略
本题难度:一般
2、填空题 室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
 假设三:????????????????????????????????????????;
假设三:????????????????????????????????????????;
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10??? KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设??????????????是正确的。
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,②??????,③干燥。???????????
步骤三:利用下图所示装置,进行定量分析:
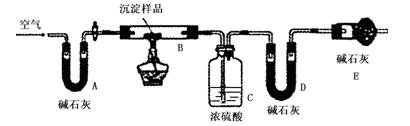
① A装置中玻璃仪器的名称是??????????????。
② 仪器组装好后首先要进行的实验操作是?????????????????。
③ 实验结束时通入过量的空气的作用是 ?????????????????。
④ 数据记录:
?
| B装置的质量(g)
| C装置的质量(g)
| D装置的质量(g)
|
实验前
| 15.4
| 262.1
| 223.8
|
试验后
| 6.1
| 264.8
| 230.4
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为????????????????????。若所得沉淀是纯净物而不是混合物,请写出该物质的化学式?????????????????????????????????。
参考答案:(一)uCO3和Cu(OH)2的混合物[2分。如果答Cu2(
本题解析:略
本题难度:一般
3、实验题 化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。某研究性学习小组用如下图装置进行铜与浓硫酸反应的实验研究。
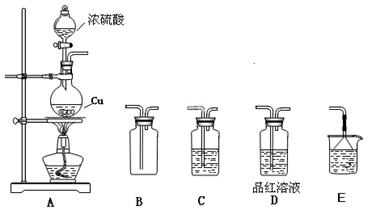
(1)装置A中发生反应的化学方程式???????????????????????????;
(2)若要使B 中收集满干燥的SO2气体(并证实B中已收集满),则上述装置的连接顺序为:???接???接????接??接???(用字母表示);
(3)C 中盛放的试剂是??????????,证明B 中已收集满SO2的现象是?????????????;
(4)待烧瓶中充分反应后,同学们发现铜有剩余,经检测发现硫酸也有剩余。检验硫酸有剩余的方法是???????????___________________;
(5)在不补充浓硫酸的前提下,为使铜进一步溶解,可向烧瓶中加入????????? ________(填序号)。① 盐酸 ?② FeSO4?? ③ Fe2O3??? ④KNO3
参考答案:(1)Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2
本题解析:略
本题难度:一般
4、实验题 甲、乙两同学为探究 与可溶性钡的强酸盐能否反应生成白色BaSO3?沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验) 与可溶性钡的强酸盐能否反应生成白色BaSO3?沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
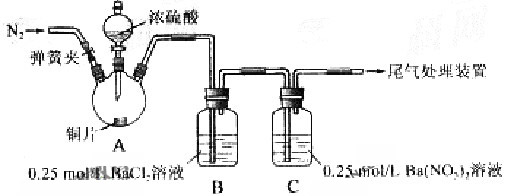
实验操作和现象:
操作
| 现象
| 关闭弹簧夹,滴加一定量浓硫酸,加热
| A中有白雾生成,铜片表面产生气泡
B中有气泡冒出,产生大量白色沉淀
C中 产生白色沉淀,液面上放略显浅棕色并逐渐消失 产生白色沉淀,液面上放略显浅棕色并逐渐消失
| 打开弹簧夹,通入N2,
停止加热,一段时间后关闭
| ???????????? ___________________
| 从B、C中分别取少量白色沉淀,加稀盐酸
| 尚未发现白色沉淀溶解
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是__________________,该沉淀的生成表明SO2具有___________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_____________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是_____________;
乙在A、B间增加洗气瓶D,D中盛放的试剂是_____________。
②进行实验,B中现象:
甲
| 大量白色沉淀
| 乙
| 少量白色沉淀
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:__________。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_______________。
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
5、实验题 (20分)实验题
Ⅰ以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
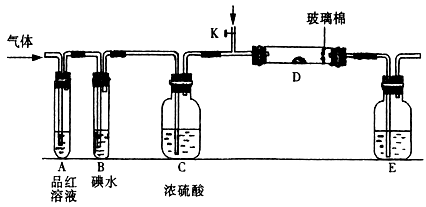
若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同????????(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为?????????????????????????????。
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为???????????????????。
(2) 某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)???????,仍然无法观察到沉淀产生。
A.氨水?????????????? B.稀盐酸??????????? C.硝酸钾溶液?????????????????? D.硫化钠溶液
(3)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为2∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式??????????????????????????????。?
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图
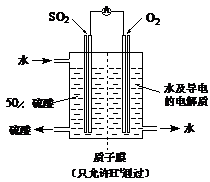
含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为_________极,其电极反应式为??????????????????????????????;电池的总反应式??????????????????????????????????????
Ⅱ实验是化学研究的基础,关于下列各装置图的叙述正确的是?????????????(填序号)
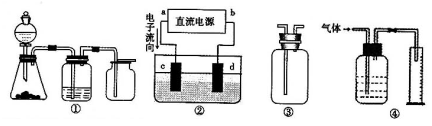
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
Ⅲ?用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是?????????(填序号)
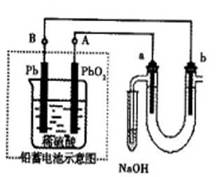
A.铅蓄电池负极的反应式为:Pb—2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-
参考答案:Ⅰ (1) ①相同?? 2SO2 + O2
本题解析:(1)①由于SO2和Cl2都可以使品红溶液褪色,所以A中分别通入SO2和Cl2,观察到的现象是相同的。
若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2,则发生SO2的催化氧化,反应方程式为2SO2 + O2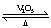 2SO3。 2SO3。
②SO2通入B中,碘水褪色,并不是SO2的漂白作用,而是SO2还原碘为无色的物质,离子方程式为:SO2 + I2 + 2H2O = 4H++ 2I-+ SO42-
(2)SO2通入装有氯化钡溶液,它只与水生成亚硫酸,得到酸性溶液,但与氯化钡是不发生化学反应的(弱酸不能制强酸),无沉淀生成;
A:加入氨水,可得到SO3—,进而生成沉淀:SO3—+Ba2+=BaSO3↓
B:加入稀盐酸,无反应发生,符合题意
C:在酸性情况下,NO3—具有强氧化性,可将SO3—氧化为SO42—,进而得到BaSO4沉淀
D:在酸性情况下,+4价硫与—2价硫发生归中反应,生成浅黄色沉淀硫
(3)由S和O的质量比为2∶3可知,两元素的个数比为1:3,即X为SO32-,此离子被被氧化成SO42-,离子方程式为:Cl2 + SO32-+H2O = SO42-+ 2Cl-+ 2H+
(4)此装置为原电池,原电池的正极发生还原反应,负极发生氧化反应,所以氧气得电子为正极:O2+4e-+4H+=2H2O;总反应为:2SO2 + O2 + 2H2O = 2H2SO4;
由总反应减去负极反应可得负极电极反应为:SO2 – 2e-+ 2H2O = 4H++ SO42-
Ⅱ、A.铜屑与稀硝酸在加热条件下才可反应,不正确
B.a极流出电子,为负极,不正确
C.各气体均不与空气反应,通过改变进出口分别采用向上或向下排气法来收集,正确
D.由于进气导管长,而出气导管短,故不能排出液体,不正确
Ⅲ、A.铅蓄电池负极的反应式为:Pb—2e-+SO42—=PbSO4
B.铅蓄电池放电时,Pb或PbO2均转变为PbSO4,两极质量均增加,不正确
C.铅蓄电池A极为电池正极,充电时应与外电源正极相连
D.a极为阳极,阴离子放电,根据放电顺序可知,首先放电的是Br-,正确
故选D
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772