微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下:
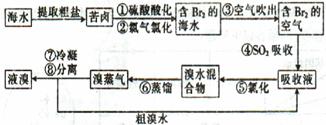
(1)目前,从海水中提取的溴约占世界溴年产量的??????????????????????。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是??????????????????????????????????。
(3)步骤④的离子方程式。?
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80?90℃。温度过高或过低都不利于生产,理由是??????????????????????????????????????????????????????????。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是???????,分离吋液溴从分离器的???????????????(填“上口”或“下口”)排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”的原因是???。
(7)某同学测得苦卤中溴的含量为0.8g·L-1,已知步骤①?⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴??????mol。
参考答案:
(1) 本题解析:
本题解析:
试题分析:(1)从海水中提取的溴约占世界溴年产量的 。
。
(2)Cl2、Br2与水反应生成酸,加入硫酸可抑制Cl2、Br2与水反应。
(3)步骤④是溴单质将SO2氧化。
(4)温度过高,会增加水蒸气,温度过低,则溴不能完全蒸出。
(5)分离溴水和液溴,应用分液漏斗。因液溴密度大于水,因此液溴从分液漏斗下口排出。
(6)氯化后的海水含溴量低。
(7)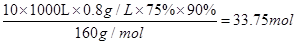 。
。
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.28g乙烯和28g丙烯中均含有6NA对共用电子对
B.在熔融状态下,lmolNaHSO4完全电离出的阳离子数目为2NA
C.7.8gNa2O2含有的阴离子数目为0.2NA
D.在1L浓度为0.1mol?L-的Na2CO3溶液中所含阴离子数为0.1NA
参考答案:A
本题解析:分析:A、分析乙烯和丙烯的组成特点,判断二者中共用电子对的关系,二者实验式相同,当两者质量相同时,含有的C、H原子数相同,因而共用电子对数当然也就相同;
B、注意区分熔融状态和溶液中NaHSO4发生不同的电离,阳离子不同,在熔融状态下形成的Na+和HSO4-;
C、注意过氧化钠的过氧键,两个氧原子共同形成一个过氧根离子O22-;
D、注意CO32-离子水解的性质,CO32-离子水解生成HCO3-离子,溶液中的CO32-离子浓度小于0.1NA.
解答:A、题中的干扰是乙烯和丙烯中的键数不等,但实质上二者实验式相同,当两者质量相同时,含有的C、H原子数相同,因而共用电子对数当然也就相同,故A正确;
B、熔化状态下能电离的只能是原有的离子键,所以形成的是Na+、HSO4-,即阳离子为NA,故B错误;
C、氧原子个数起干扰作用,实质上两个氧原子共同形成一个过氧根离子O22-,即为0.1 NA,故C错误;
D、Na2CO3为强碱弱酸盐,在溶液中,由于CO32-离子水解生成HCO3-离子,则溶液中的CO32-离子浓度小于0.1NA,故D错误.
故选A.
点评:本题考查阿佛加德罗常数的有关知识,做题时注意分析物质存在的条件、聚集状态、物质的结构特点以及物质的性质等问题.
本题难度:简单
3、选择题 除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及其顺序正确的是
A.AgNO3、Na2CO3、HNO3
B.AgNO3、Na2CO3、HCl
C.Na2CO3、AgNO3、HNO3
D.AgNO3、K2CO3、HNO3
参考答案:A
本题解析:
试题分析:根据除杂的原则,选择适当的试剂,NaCl用硝酸银溶液、Ca(NO3)2用Na2CO3溶液;再根据除杂的试剂是过量的,确定试剂的顺序以及所需试剂,为了把过量的硝酸银溶液除去,可用Na2CO3溶液来除,最后过量的Na2CO3溶液可用硝酸来除,而过量的硝酸可加热挥发。首先加入过量的硝酸银,将氯离子全部沉淀,因此溶液中就有了过量的Ag+离子,然后向溶液中加入过量的Na2CO3,Ca+和Ag+都形成沉淀,这样溶液中就有了过量的CO32-,向溶液中加入过量的硝酸,将CO3?2-变成CO2除去,溶液中含有了过量的HNO3,因为硝酸易挥发,加热可以将硝酸除去,最后得到纯净的NaNO3.故选A。
本题难度:一般
4、选择题 用括号内试剂除去下列各物质中的少量杂质,正确的是
A.溴苯中的溴(氯化钾溶液)
B.溴乙烷中的乙醇(H2O)
C.SO2中混有CO2(澄清石灰水)
D.乙醇中的乙酸(NaOH溶液)
参考答案:B
本题解析:A项应选择NaOH溶液除去溴苯中溴。C项SO2、CO2均与澄清石灰水反应,产生白色沉淀,故此法不合适。D项乙醇中含有乙酸杂质,需在加入NaOH溶液后再进行一次蒸馏方能将乙酸除去。故A、C、D的除杂方法都是不正确的,答案选B。
本题难度:一般
5、选择题 有一瓶无色气体,可能含有CO2、HBr、SO2、HCl、NO2中的若干种,将其通入氯水中,得无色透明溶液。将此溶液分成两份,向其中一份加入BaCl2溶液,有白色沉淀产生;向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀产生。则下列结论正确的是( )
A.肯定有SO2、HCl
B.一定没有CO2、HBr、NO2
C.可能有HBr、CO2
D.一定有SO2,可能有HCl、CO2
参考答案:D
本题解析:
试题分析:根据题意知,气体为无色,则原气体中没有NO2气体;将混合气体通入氯水中,得无色透明溶液,则原气体中没有HBr。将溶液分成两份,向其中一份加入BaCl2溶液,有白色沉淀产生,说明一定有SO2,向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀产生,因通入氯水中,无法确定氯化氢是否存在;二氧化碳气体不能确定;选择D。
本题难度:一般