微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定量的Zn与一定浓度的H2SO4反应,生成气体在标准状况下体积为2.24L。下列关于反应消耗的H2SO4的物质的量的推测肯定正确的是
A.n(H2SO4)=0.1mol
B.n(H2SO4)=0.2mol
C.0.1mol<n(H2SO4) <0.2mol
D.0.1mol≤n(H2SO4)≤0.2mol
参考答案:D
本题解析:一定量的Zn与一定浓度的H2SO4反应,生成气体可能是氢气、也可能是二氧化硫、还可能是二者的混合物。气体为0.1mol。?如是二氧化硫,则硫酸物质的量为0.2mol;?如是氢气,则二氧化硫物质的量为0.1mol;?如是二者的混合物,则硫酸:0.1mol≤n(H2SO4)≤0.2mol。
点评:考查金属和酸的反应,注意整个过程中酸的被稀释问题。
本题难度:简单
2、选择题 下列叙述正确的是( )
A.1.00molNaCl中含有6.02×1023个NaCl分子
B.1.00molNaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配置1.00L,1.00mol.L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中
D.电解58.5g熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
参考答案:A、因NaCl为离子化合物,则不存在NaCl分子,故A错误;
本题解析:
本题难度:一般
3、选择题 设NA代表阿伏加德罗常数的值,下列叙述不正确的是
A.7.8g Na2O2固体中含有的阴阳离子总数为0.6NA
B.25℃时,1L pH=13的NaOH溶液中由水电离出来的OH-个数约为1×10-13NA
C.4.4g CO2所含有的成键电子数约为0.8NA
D.在标准状况下,等质量的N2和CO的分子数均为NA
参考答案:A
本题解析:A.Na2O2固体中含有的阴阳离子个数比为2:1,故总数为0.3NA,
B.此时的NaOH溶液水的电离爱抑制,由水电离出来的OH-个数与溶液中的H+数目相同,即1×10-13NA,
C.每个CO2所含有的成键电子数为8个,故为0.8NA,
D.两者的质量与摩尔质量相同,故物质的量相同,
故选A
本题难度:一般
4、选择题 在配制物质的量浓度溶液的实验中,最后用胶头滴管定容后,液面正确的是[???? ]
A.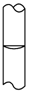
B.
C.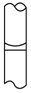
D.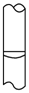
参考答案:B
本题解析:
本题难度:简单
5、选择题 已知:NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:
Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品A 9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)
盐酸体积(mL)
| 8
| 15
| 20
| 50
| x
| 120
| 150
| 生成CO2体积(mL)
| 0
| 112
| 224
| 896
| 2240
| 2240
| 2240
下列说法中不正确的是(??? )
A.x的最小值为110
B.x的最小值为100
C.所加盐酸物质的量浓度为1.0mol/L
D.样品A中NaHCO3和Na2CO3·nH2O的物质的量分别为0.090mol和0.010mol
参考答案:B
本题解析:该题考查知识点为有关溶液物质的量浓度的计算。若纯粹考查计算会比较单一,结合反应和对数据的分析考查能体现学生分析问题的能力。
由表中数据,加入8 mL盐酸时没有二氧化碳气体生成,说明样品中含有Na2CO3·nH2O。发生反应的方程式为:Na2CO3·nH2O+HCl= NaHCO3+NaCl+nH2O…①,NaHCO3+HCl=CO2↑+NaCl+H2O…②。当加入15mL盐酸时生成112 mLCO2气体,当加入20mL盐酸时生成224 mLCO2气体,可得出当Na2CO3·nH2O与HCl完全生成N
本题难度:一般
|
|