本题解析:(1)氯气有毒,必须进行尾气处理
(2)变为蓝色则平衡向逆方向移动,可以加水,增加生成的浓度,也可以加入AgNO3溶液减少Cl-浓度。
(3)Cu2+易发生水解,加热促进水解,同时HCl易挥发,也促进水解,所以直接加热得不到氯化铜晶体。
本题难度:困难
2、选择题 50℃时,0.1mol·L-1Na2CO3溶液pH=12,下列判断正确的是
A.c(OH-)=10-2mol·L-1
B.加入少量NaOH固体,c(Na+)和c(CO32-)均增大
C.c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
D.2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
参考答案:B
本题解析:
试题分析:A、因为50℃时,Kw未知,则pH=12,只能说明氢离子浓度为10-12mol/L,则氢氧根离子浓度无法计算,错误;B、碳酸钠溶液中,存在CO32-+H2O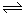 HCO3-+OH-,加入少量NaOH固体,氢氧根离子浓度增大,水解平衡逆向移动,c(Na+)和c(CO32-)均增大,正确;C、根据电荷守恒,则c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),错误;D、根据物料守恒,则c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),错误,答案选B。
HCO3-+OH-,加入少量NaOH固体,氢氧根离子浓度增大,水解平衡逆向移动,c(Na+)和c(CO32-)均增大,正确;C、根据电荷守恒,则c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),错误;D、根据物料守恒,则c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),错误,答案选B。
考点:考查电解质溶液中离子浓度的判断,水解平衡移动、溶液中离子浓度大小比较的知识。
本题难度:一般
3、填空题 (14分)25℃时0.1 mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:
甲认为:醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;
乙认为:醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中 的________(填写编号),然后测定溶液的pH.(已知25℃时,CH3COONH4溶液呈中性).
A.固体CH3COOK
B.固体CH3COONH4
C.气体NH3
D.固体NaHCO3
(2)加入(1)中物质后,若甲的解释正确,溶液的pH应________;若乙的解释正确,溶液的pH应________;(填“增大”“减小”或“不变”).
(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液.判断:
①溶液中共有________种粒子;
②其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol.
参考答案:(1)B (2)不变 增大(3)①7 ②CH3COOH CH
本题解析:
试题分析:(1)CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,CH3COONH4加入到0.1 mol?L-1醋酸中使pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明,故答案为:B;(2)醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,则溶液pH增大,故答案为:增大;(3)①将0.010molCH3COONa和0.004molHCl溶于水,由于发生CH3COO-+H+?CH3COOH,溶液中存在CH3COO-、Cl-、OH-、H+、Na+、CH3COOH和H2O等粒子,共7种,故答案为:7;②根据物料守恒可知,0.010mol CH3COONa在溶液中以CH3COOH和CH3COO-存在,n(CH3COOH)+n(CH3COO-)=0.010mol,故答案为:CH3COOH;CH3COO-;③溶液遵循电荷守恒,存在:n(H+)+n(Na+)=n(Cl-)+n(CH3COO-)+n(OH-),则n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol,故答案为:0.006.
考点:盐类水解的原理
本题难度:一般
4、选择题 常温下,下列盐溶于水时,能使水的电离程度增大且c(H+)也增大的是
A.NaHSO4
B.KAl(SO4)2
C.NaHCO3
D.CH3COONa
参考答案:B
本题解析:试题分析:水是弱电解质,存在电离平衡,即H2O H++OH-。A中硫酸氢钠能电离出氢离子,溶液中氢离子浓度增大,但抑制水的电离,A不正确;B中的Al3+水解,溶液显酸性,且促进水的电离,B正确;碳酸氢钠溶于水,水解程度大于电离程度,促进水的电离,但溶液显碱性,C不正确。D中醋酸钠溶于水,CH3COO-水解,促进水的电离,但溶液显碱性,D不正确,答案选B。
H++OH-。A中硫酸氢钠能电离出氢离子,溶液中氢离子浓度增大,但抑制水的电离,A不正确;B中的Al3+水解,溶液显酸性,且促进水的电离,B正确;碳酸氢钠溶于水,水解程度大于电离程度,促进水的电离,但溶液显碱性,C不正确。D中醋酸钠溶于水,CH3COO-水解,促进水的电离,但溶液显碱性,D不正确,答案选B。
考点:考查弱电解质的电离、盐类水解
点评:该题是中等难度的试题,主要是考查学生对水电离平衡特点、盐类水解以及外界条件对水电离平衡影响的了解掌握情况,意在培养学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:简单
5、选择题 向NaOH(aq)滴入HAc(aq)的过程中,溶液中离子浓度的大小可能正确的是
A.c(OH-) = c(Na+) > c(Ac-) > c(H+)
B.c(Na+) > c(OH-) = c(Ac-) > c(H+)
C.c(Na+) > c(Ac-) > c(OH-) > c(H+)
D.c(H+) > c(Ac-) > c(Na+) > c(OH-)
参考答案:BC
本题解析:
试题分析:A.根据电荷守恒,溶液中存在,c(OH-)+c(Ac-)=c(Na+)+c(H+),如c(OH-)=c(Na+),应存在c(Ac-)=c(H+),故A错误;B.如为NaOH和NaAc的混合物,溶液呈碱性,可满足c(Na+)>c(OH-)=c(Ac-)>c(H+),故B正确;C.当溶液为NaAc时,溶液呈碱性,可满足c(Na+)>c(Ac-)>c(OH-)>c(H+),故C正确;
D.阳离子大于阴离子,电荷不是守恒,故D错误.故选BC。
考点:本题考查离子浓度大小比较,题目难度不大,注意电荷守恒的运用,把握盐类水解和盐类水解的原理。
本题难度:一般