微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
简答题 NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
(1)此消毒液可吸收空气中的CO2生成NaHCO3而变质.写出化学反应方程式?.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过以下装置检验气体的成分可以判断消毒液是否变质.
限选试剂:98%浓硫酸、1%品红溶液、1.0mol?L-1?KI-淀粉溶液、1.0mol?L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案.
| ????所加试剂 | ???????????? 预期现象和结论
试管A中加足量①?;
试管B中加1%品红溶液;
试管C中加②?.
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊.则消毒液部分变质;
③?则消毒液未变质;
④?则消毒液完全变质.
(3)用滴定法测定消毒液中NaClO的浓度.实验步骤如下:
①量取25.00mL消毒液放入锥形瓶中,加入过量的a?mol?L-1Na2SO3溶液b?mL;
②滴定分析.将c?mol?L-1的酸性KMnO4溶液装入?(填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应.当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据.重复滴定实验2次,平均消耗酸性KMnO4溶液v?mL;
滴定过程中涉及的反应有:NaClO+Na2SO3=NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O.
③计算.消毒液中NaClO的浓度为?mol?L-1(用含a、b、c、v的代数式表示).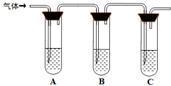
简答题 NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
(1)此消毒液可吸收空气中的CO2生成NaHCO3而变质.写出化学反应方程式?.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过以下装置检验气体的成分可以判断消毒液是否变质.
限选试剂:98%浓硫酸、1%品红溶液、1.0mol?L-1?KI-淀粉溶液、1.0mol?L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案.
| ????所加试剂 | ????????????预期现象 和结论
试管A中加足量①?;
试管B中加1%品红溶液;
试管C中加②?.
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊.则消毒液部分变质;
③?则消毒液未变质;
④?则消毒液完全变质.
(3)用滴定法测定消毒液中NaClO的浓度.实验步骤如下:
①量取25.00mL消毒液放入锥形瓶中,加入过量的a?mol?L-1Na2SO3溶液b?mL;
②滴定分析.将c?mol?L-1的酸性KMnO4溶液装入?(填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应.当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据.重复滴定实验2次,平均消耗酸性KMnO4溶液v?mL;
滴定过程中涉及的反应有:NaClO+Na2SO3=NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O.
③计算.消毒液中NaClO的浓度为?mol?L-1(用含a、b、c、v的代数式表示).
本题答案:
本题解析:
本题所属考点:【实验方案的设计与评价】
本题难易程度:【一般】
You never know what you can do till you try. 不尝试就不知道你能做什么. |
|