微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是(??? )
A.决定反应速率的因素只有催化剂
B.放在工作中的冰箱里,食物变质的速率会减慢
C.锌与稀硫酸反应时,加人少量水能加快产生氢气的速率
D.2 mol SO2与1molO2混合一定能生成2 mol SO3
参考答案:B
本题解析:
试题分析:A.催化剂、升高温度和反应物浓度是影响化学反应速率的因素,反应物本身的性质是内部因素,是决定化学反应速率的主要因素;A选项错误。B.温度影响化学反应速率,降低温度化学反应速率减慢。B选项正确。C.加人少量水使得稀硫酸浓度变得更稀,会减慢产生氢气的速率。C选项错误。
D.2SO2+O2 2S
2S
本题难度:一般
2、简答题 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂
①
10mL2%?H2O2溶液
无
②
10mL5%?H2O2溶液
无
③
10mL5%?H2O2溶液
1mL0.1mol?L-1FeCl3溶液
④
10mL5%?H2O2溶液+少量HCl溶液
1mL0.1mol?L-1FeCl3溶液
⑤
10mL5%?H2O2溶液+少量NaOH溶液
1mL0.1mol?L-1FeCl3溶液
(1)催化剂能加快化学反应速率的原因是______.
(2)实验①和②的目的是______.实验时由于较长时间没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是______.
(3)写出实验③的化学反应方程式______.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析上图能够得出的实验结论是______.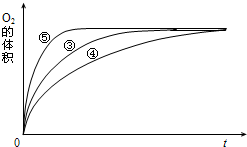
参考答案:(1)催化剂改变反应的途径,降低反应所需的活化能,从而加快反
本题解析:
本题难度:一般
3、填空题 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________
________________________________________________________________________。
(2)要加快上述实验中气体产生的速率,还可采取的措施有______________________
__________________________________________________________________(答两种)。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量锌粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液
| A
| B
| C
| D
| E
| F
| 4 mol/LH2SO4/mL
| 30
| V1
| V2
| V3
| V4
| V5
| 饱和CuSO4溶液/mL
| 0
| 0.5
| 2.5
| 5
| V6
| 20
| H2O/mL
| V7
| V8
| V9
| V10
| 10
| 0
其中:V1= ,V6 ,V9= 。
参考答案:(1)CuSO4+Zn=ZnSO4+Cu,Zn+H2SO4=
本题解析:
试题分析:(1)锌能和硫酸铜溶液发生置换反应生成铜,从而构成铜锌原电池,加快反应速率,则有关氟方程式是CuSO4+Zn=ZnSO4+Cu,Zn+H2SO4=ZnSO4+H2↑。
(2)影响反应速率的因素还有温度、浓度以及表面积等,所以还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等。
(3)要探究外界条件对反应速率的影响,则只能是改变1个变量。根据表中数据可知,变化的是硫酸铜和水的体积,稀硫酸的体积使不变的,则V1=30ml。溶液的硫酸铜和水的体积之和是20ml,所以V6=20ml-10ml10ml,V9=20ml-2.5ml=17.5ml。
考点:考查外界条件对反应速率对影响的有关实验探究
点评:该题是中等难度的试题,侧重对学生实验探究能力的培养,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。也有助于调动学生的学习兴趣,激发学生的学习积极性。
本题难度:一般
4、选择题 用铁片与稀硫酸反应制备氢气时,下列措施不能使氢气生成速率加快的是(?)


A.铁片改为铁粉
B.稀硫酸改为98% 浓硫酸

C.对该反应体系加热
D.铁片改为锌片
参考答案:B
本题解析:略
本题难度:简单
5、填空题 已知草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。
(1)草酸的电离方程式为 。
(2)将草酸溶液与酸性高锰酸钾溶液混合发生的反应为:
MnO4-+ H2C2O4+ → Mn2+ + CO2↑+ H2O
某合作小组同学在烧杯中进行上述反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
①配平上述离子方程式
②该实验不久后溶液突然褪色的原因最有可能是 。
A.体系压强增大 B.反应物接触面积增大
C.生成物对反应有催化作用 D.反应物浓度增大
(3)为研究该化学反应速率的影响因素,某同学进行了以下实验:
组别
| 温度/℃
| V(H2C2O4)
/mL
| V(KMnO4)
/mL
| V(H2O)
/mL
| KMnO4溶液
褪色时间/s
| 1
| 30
| 10
| 10
| 20
| 40
| 2
| 30
| 20
| 20
| 0
| t
| 3
| 30
|
|
| 15
|
①对比实验1和3要研究改变反应物浓度对化学反应速率的影响,请完成表格中横线。
②实验2中溶液褪色时间t 为
A.>40 B.=40 C.<40 D.无法判断
参考答案:(10分)(1)H2C2O4 本题解析: 本题解析:
试题分析:(1)草酸(H2C2O4)是一种二元弱酸,电离方程式为H2C2O4 H++ HC2O4—;(2)①根据化合价升降法及元素守恒配平离子方程式为2MnO4-+5H2C2O4+6H+ ==2Mn2++10CO2↑+8H2O ;②溶液突然褪色,说明反应速率突然增大,原因最有可能是催化剂,答案选C;(3)①变量控制,总体积为40ml,加水15ml,与实验1比较,可得答案;②反应不是均速进行,由于生成物有催化作用,无法确定褪色时间,答案选D。 H++ HC2O4—;(2)①根据化合价升降法及元素守恒配平离子方程式为2MnO4-+5H2C2O4+6H+ ==2Mn2++10CO2↑+8H2O ;②溶液突然褪色,说明反应速率突然增大,原因最有可能是催化剂,答案选C;(3)①变量控制,总体积为40ml,加水15ml,与实验1比较,可得答案;②反应不是均速进行,由于生成物有催化作用,无法确定褪色时间,答案选D。
考点:草酸的性质、电离、氧化还原反应、化学反应速率
本题难度:困难
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772