微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将1.92 g铜粉与一定量浓硝酸反应,当铜粉完全反应时收集到气体1.12 L(标准状况)。则所消耗硝酸的物质的量是(???)
A.0.12 mol
B.0.11 mol
C.0.09 mol
D.0.08 mol
参考答案:B
本题解析:1.92 g铜,即0.03 mol铜,与硝酸完全反应,失去电子的物质的量为2×0.03 mol,若HNO3的还原产物仅为NO2,根据电子得失相等,n(NO2)=2×0.03 mol,
V(NO2)=2×0.03 mol×22.4 L·mol-1="1.344" L>1.12 L
说明:HNO3的还原产物不仅为NO2,还有NO,因为随着反应的进行,硝酸的浓度不断降低,必然发生如下两个反应:
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3
本题难度:简单
2、选择题 导电仪测得液态BrF3具有微弱的导电性,表示BrF3(液)中有阴、阳离子X和Y。X和Y也存在于BrF2SbF6、KBrF4、(BrF2)2SnF6等化合物中,则X、Y的化学式分别为……( )
A.X=F-;Y=Br3+
B.X=BrF4-;Y=BrF2+
C.X=F-;Y=BrF2+
D.X=BrF4-;Y=Br3+
参考答案:B
本题解析:同学们所说的自耦电离是正确的。
突破该题关键是抓住第二个离子化合物KBrF4。X、Y存在于3种物质中,显然离子化合物KBrF4电离出K+和BrF4-离子,那么阴离子X即为BrF4-,再根据原子守恒和电荷守恒,BrF3的电离为:2BrF3<==>BrF4-+BrF2+,那么Y为BrF2+。
本题难度:简单
3、选择题 工业制取硝酸的尾气含有NO2,NO,通常用NaOH吸收:
NO+NO2+2NaOH=2 Na NO2+H2O
2 NO2+2NaOH=Na NO2+Na NO3+H2O
NO2与NO体积比为下列值时,不能被完全吸收的是
A.1∶1 
B.1∶3
C.3∶1
D.2∶1
参考答案:B
本题解析:略
本题难度:一般
4、选择题 关于氮的单质及化合物的说法不正确的是
A.氮气化学性质稳定,其合成氨的低温催化剂研究、模拟生物固氮是提高氮气合成氨生产能力的最新方向
B.久置浓HNO3呈黄色,是由于HNO3具有不稳定性
C.铜分别与浓HNO3、稀HNO3反应,还原产物分别为NO2、NO,所以浓HNO3氧化性小于稀HNO3
D.氮化镁与足量盐酸反应,能生成两种盐
参考答案:C
本题解析:略
本题难度:简单
5、实验题 某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列实验方法制备氨气,其中合理的是???????????(填序号,下同)。
A.将氯化铵固体加热分解
B.将浓氨水滴入氢氧化钠固体中
C.将氢氧化钠固体加入浓氨水中
D.将氯化铵稀溶液滴入氢氧化钠固体中
(2)如图是甲同学设计收集氨气的几种装置,其中可行的是???????,集气的原理是???????????????????????????????????????????。
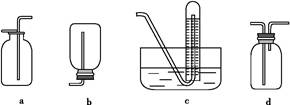
参考答案:(1)B
(2)d?利用氨气密度小于空气,采用短管进氨
本题解析:(1)加热氯化铵产生氯化氢和氨气,遇冷又转化为氯化铵固体,不能制取氨气;用浓氨水与氢氧化钠固体混合制氨气时,将氨水滴入氢氧化钠固体中更方便操作,而且节约氨水的用量;氨气极易溶于水,若用稀溶液制取,产量较少。(2)氨气极易溶于水,采用向下排空气法收集。
本题难度:一般