微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为 ( )
A.c (CH3COO-)="c" (Na+)
B.c (OH-)>c (H+)
C.c (CH3COOH)>c (CH3COO-)
D.c (CH3COOH)+c (CH3COO-)=0.01mol/L
参考答案:D
本题解析:
试题分析:0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和后,所得溶液中含有得溶质是醋酸和醋酸钠,且二者得物质的量是相等得。由于不能确定溶液得酸碱性,因此选项A、B、C都是不一定正确得。根据物料守恒可知,选项D正确,答案选D。
考点:考查溶液中离子浓度大小比较
点评:比较溶液中离子浓度时,一般遵循几个关系式,即电荷守恒定律、物料守恒和质子守恒。另外在水解应用时,,还需要具体问题具体分析,不可随意套用。
本题难度:困难
2、选择题 25?℃时,水的电离达到平衡:H2O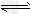 H++OH-;ΔH>0,下列叙述正确的是[???? ]
H++OH-;ΔH>0,下列叙述正确的是[???? ]
A.向水中加入稀氨水,水的电离程度增大
B.向水中加入少量固体醋酸钠,平衡逆向移动,c(H+)降低
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
D.将水加热,平衡逆向移动
参考答案:C
本题解析:
本题难度:一般
3、实验题 (12分)Ⅰ.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B.用标准溶液润洗滴定管2-3次
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)实验中眼睛注视_______ ,直至滴定终点。判断到达终点的现象是___________ 。
(3)滴定前平视KOH液面,刻度为amL,滴定后俯视液面刻度为bmL,则(b-a)mL比实际消耗KOH溶液体积 (填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际 填“大”或“小”)。
(4)若酸式滴定管没有用盐酸润洗,对测定结果有何影响____________(填“偏大”、“偏小”或“无影响”,其他操作均正确)。
参考答案:(1)BDCEAF
(2)锥形瓶中溶液的颜色变化;锥形
本题解析:
试题分析:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,故答案为:BDCEAF;(2)实验中眼睛注视锥形瓶中溶液的颜色变化;判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。(3)滴定前平视KOH液面,刻度为amL,滴定后俯视液面,读数读小了,刻度为bmL,则(b-a)mL比实际消耗KOH溶液体积少。根据(b-a)mL计算得到的待测浓度,比实际偏小;(4)若酸式滴定管没有用盐酸润洗,则盐酸的浓度降低,导致消耗NaOH少,测定结果偏小。
考点:考查酸碱中和滴定。
本题难度:一般
4、选择题 常温下,用0.1000 mol/L HCl溶液滴定20.00 mL 0.1000 mol/L NH3?H2O溶液,滴定曲线如下图。下列说法正确的是
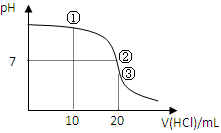
A.①溶液:c(C1—)>c(NH4+)>c(OH—)>c(H+)
B.②溶液:c(NH4+)=c(C1—)>c(OH—)=c(H+)
C.③溶液:c(H+)>c(NH3·H2O) + c(OH—)
D.滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH—)>c(Cl—)>c(H+)
参考答案:BD
本题解析:根据电荷守恒c(C1—)+c(OH—)=c(NH4+)+c(H+)可知,A不正确。②表示溶液显中性,根据电荷守恒可判断,B正确。③表示盐酸和氨水恰好反应,溶液中只有氯化铵,水解显酸性。根据质子守恒可知,c(H+)=c(NH3·H2O) + c(OH—),C不正确。当加入的盐酸很少时,可能出现选项D中的关系,所以答案选BD。
本题难度:困难
5、选择题 pH相同的氨水和NaOH溶液,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液的pH仍然相同,则m和n的关系是
A.m<n
B.m=n
C.m>n
D.不能确定
参考答案:C
本题解析:
试题分析:氨水是弱碱溶液,氢氧化钠是强碱,pH相同的二者,氨水的浓度大于氢氧化钠溶液的浓度,若稀释相同的倍数,由于氨水的稀释会促进一水合氨的电离,所以稀释后的二者中,氨水的pH较大,若稀释后溶液的pH仍相同,则氨水的稀释倍数大于氢氧化钠溶液,则m>n,答案选C。
考点:考查溶液稀释规律
本题难度:一般