微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)
(1)电解精炼铜阳极的主要反应是????????,还会发生的反应有?????(任写一个)。
(2)电解精炼铜的阳极泥中含有铜和金、银等贵重金属及稀有金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下:
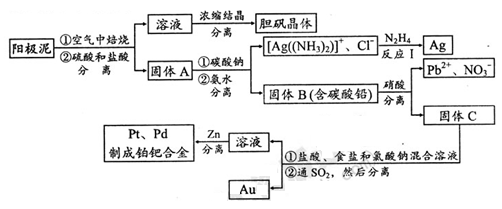
请回答下列问题:
①各步生产流程中都涉及了同一种分离方法,实验室中不能用这种方法来分离液态胶体中分散质与分散剂的原因是?????????????????????????????????????????。
②用硝酸处理固体B中碳酸铅的离子方程式是???????????????????。
③反应I中肼(N2H4)的作用是????????????????????????????????。
④固体C用盐酸、食盐和氯酸钠混合溶液处理后得到H2PtCl6、AuCl3、PdCl2。反应中每消耗lmol氧化剂要转移????????????mol e-;在AuCl3溶液中通入SO2生成单质金,当生成19.7gAu时,25℃和101kPa下反应消耗???????L SO2(此条件下的气体摩尔体积为24.5L/mol)。
参考答案:(1)Cu-2e-=" Cu" 2+、Fe-2e-=" Fe
本题解析:粗铜中含金、银、铁、镍、锌等杂质,电解时铜、铁、镍、锌被氧化,金、银作为阳极泥而沉淀下来;上述各流程均用到过滤操作,而胶体中各微粒均可通过滤纸孔隙,所以不能用过滤来分离液态胶体中分散质与分散剂;整个流程首先通过煅烧将铜最终变为胆矾;固体A含氯化银、硫酸铅、金、稀有金属等,用碳酸钠将硫酸铅转化为碳酸铅,再用硝酸溶解而将铅分离(这里用到沉淀的生成、转化、溶解),用氨水溶解氯化银变为银氨溶液,最后用N2H4将其还原为银;固体C含金、稀有金属等,用盐酸、氯化钠、氯酸钠等将它们溶解得到H2PtCl6、AuCl3、P
本题难度:一般
2、选择题 某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu,

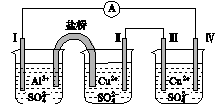
则下列说法正确的是
A.电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ
B.电极Ⅰ发生还原反应
C.电极Ⅳ逐渐溶解
D.电极Ⅲ的电极反应:Cu-2e-===Cu2+
参考答案:D
本题解析:
试题分析:A.根据原电池的构成原理,可知电极Ⅰ为负极,电极Ⅱ为正极,电极Ⅲ为阳极,电极Ⅳ为阴极。电子流向为电极Ⅰ→ →电极Ⅳ,电极Ⅲ→电极Ⅱ,错误;B. 电极Ⅰ为负极,发生氧化反应,错误;C. 电极Ⅳ发生的电极反应为:Cu2++2e-=Cu,电极逐渐变粗,错误;D.电极Ⅲ为阳极,电极反应为:Cu-2e-===Cu2+,正确;选D。
→电极Ⅳ,电极Ⅲ→电极Ⅱ,错误;B. 电极Ⅰ为负极,发生氧化反应,错误;C. 电极Ⅳ发生的电极反应为:Cu2++2e-=Cu,电极逐渐变粗,错误;D.电极Ⅲ为阳极,电极反应为:Cu-2e-===Cu2+,正确;选D。
活性阳极Cu在此被氧化,D项错误。
考点:考查原电池的工作原理。
本题难度:一般
3、选择题 如图所示a、b 都是惰性电极,通电—段时间后,a极附近溶液显红色。下列说法中正确的是(??? )。
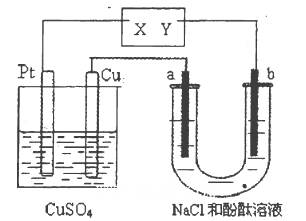 ?????
?????
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的浓度逐渐减小
D.CuSO4溶液的pH减小
参考答案:B
本题解析:
试题分析:该装置为电解装置,a极显红色,说明a极氢氧根离子浓度增大,氢离子浓度减小,所以a极氢离子放电,则a极为阴极,b极为阳极,Y为正极X为负极,A错误;B正确;因此铂极为阴极,铜离子放电成为单质铜,铜极为阳极,铜放电成为铜离子进入溶液,所以CuSO4溶液的浓度基本不变,pH基本不变,C、D错误,答案选B。
本题难度:简单
4、填空题 已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
①A+B  M+D+E;②E+M=A+F+B
M+D+E;②E+M=A+F+B
请回答:
(1)若A是一种钠盐,该反应是化学工业上制单质E和化合物M的重要方法。该化学工业称为??????(填字母编号:a.硫酸工 业? b.氯碱工业? c.合成氨工业d.侯氏制碱工业),写出上述反应②的离子方程式为__________??????????。
(2)若A是一种含氧酸盐,该反应中电极上会析出红色固体。则其电解反应方程式是: ???????????????。上述两种不同反应中的产物E((1)题)和产物F((2)题)有一种共同的用途是__??????????????? ____, 二者反应的离子方程式为______________??????????????????????__。
参考答案:(共9分,第1空1分,其余各2分)(1)氯碱工业, Cl2+
本题解析:
试题分析:(1)若A是一种钠盐,该反应是化学工业上制单质E和化合物M的重要方法,则该化学工业称为氯碱工业,所以A是氯化钠,B是水,M是氢氧化钠。则根据反应②可知,E是氯气,所以D是氢气,F是次氯酸钠,因此反应②的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
(2)若A是一种含氧酸盐,该反应中电极上会析出红色固体,则A应该是硫酸铜,B是水,E是铜,M是硫酸,F是二氧化硫,D是氧气,所以电解反应方程式是2CuSO4+2H2O 本题难度:一般
本题难度:一般
5、填空题 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知:
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ;△Ha = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ;△H b =-566.0 kJ·mol-1
(1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:______________________
(2)甲醇作为燃料,它的优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用(1)中的热化学方程式计算,完全燃烧20g甲醇,生成二氧化碳和水蒸汽时,放出的热量为__________kJ,生成的CO2气体标准状况下体积是___________L
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在____________极反应;电极反应式为__________________________。
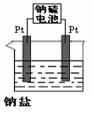
(4)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是___________(填序号)
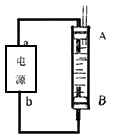
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化是__________________________,反应的化学方程式为
_________________________。
参考答案:(1)2CH3OH(1)+3O2(g)==2CO2(g)+4
本题解析:
本题难度:一般