微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 标准状况下,将a LSO2和Cl2组成的混合气体通入100mL0.1mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65g。则下列关于该过程的推断不正确的是
A.混合气体中SO2的体积为0.448L(标况)
B.所得沉淀为0.05mol的BaSO4
C.a L混合气体的物质的量为0.04mol
D.a的取值范围为 0.672<a<0.896
参考答案:C
本题解析:
试题分析:SSO2和Cl2组成的混合气体通入Fe2(SO4)3溶液中,由于氯气的氧化性强于铁离子,故氯气先与二氧化硫反应:SO2+Cl2+2H2O=2HCl+H2SO4,充分反应后,溶液的棕黄色变浅,说明铁离子氧化二氧化硫:2Fe3++SO2+H2O=SO42-+2Fe2++2H+,二氧化硫完全反应,反应后的溶液足量的BaCl2溶液,生成的11.65g沉淀为BaSO4,其物质的量为:n(BaSO4)=11.63g÷233g/mol=0.05mol,根据硫元素守恒可知n(BaSO4)=3n[Fe2(SO4)3]+n(SO2),故n(SO2)=0.05mol-3×0.1L×0.1mol?L-1=0.02mol,A.根据上述分析可知,V(SO2)=0.02mol×22.4L/mol=0.448L,故A正确;B.生成的11.65g沉淀为BaSO4,其物质的量为:n(BaSO4)=11.63g÷233g/mol=0.05mol,故B正确;C.由上述分析可知,V(SO2)=0.02mol×22.4L/mol=0.448L,由于硫酸铁氧化二氧化硫,根据方程式可知n(Cl2)<n(SO2),故n(Cl2)<0.02mol,故V(Cl2)<0.02mol×22.4L/mol=0.448L;又由于被氧化的二氧化硫为0.02mol,而100mL0.1mol?L-1Fe2(SO4)3溶液中含有0.01mol硫酸铁,含有0.02mol铁离子,根据反应2Fe3++SO2+H2O=SO42-+2Fe2++2H+可知,0.02mol铁离子最多氧化0.01mol二氧化硫,剩余的0.01mol二氧化硫需要0.01mol氯气氧化,所以氯气的物质的量最少为0.01mol,标况下0.01mol氯气的体积为0.224L,则混合气体最小体积为:0.448L+0.224L=0.672L,故a的取值范围为0.672<a<0.896,故C错误;D.根据C可知,a的取值范围为:0.672<a<0.896,故D正确;故选C。
考点:考查混合物的有关计算
本题难度:一般
2、选择题 有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入足量澄清石灰水中,得到0.75 g沉淀。这种铁的氧化物的化学式是(?)
A.FeO
B.Fe2O3
C.Fe3O4
D.FeO和Fe2O3
参考答案:B
本题解析:CO和铁的氧化物反应时,氧化物中的一个O原子对应一个CO2分子,每一个CO2分子对应一个CaCO3,所以有下列的关系式,假设0.4 g该氧化物中含x g O原子。
O ~ CO2 ~ CaCO3
16????????????????100
x g???????????????0.75 g
解得x=0.12
N(Fe)∶N(O)=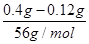 本题难度:一般
本题难度:一般
3、选择题 在a LAl2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的SO42-离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为(假设溶液的体积仍为aL)[???? ]
A.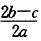
B.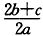
C.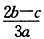
D.
参考答案:C
本题解析:
本题难度:一般
4、填空题 向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:

(1)OA段、AB段发生反应的离子方程式__________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是______________。
参考答案:(1)CO32-+H+=HCO3—?????HCO3– +H
本题解析:
试题分析:(1)根据题意知,向某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液,向上述所得溶液中逐滴滴加2 mol·L-1的盐酸发生的反应依次为CO32-+H+═HCO3-,HCO3– +H+=CO2↑+H2O;即OA段、AB段发生反应的离子方程式CO32-+H+═HCO3-,HCO3– +H+=CO2↑+H2O;(2)根据题意知,B点时,反应所得溶液中溶质为NaCl,根据氯元素守恒得,n(NaCl)= n(HCl)=0.3L×2mol/L
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.78 g 苯含有碳碳双键的数目为3NA
B.常温常压下,22.4 L二氧化碳含有的原子总数为3NA
C.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA
D.1 mol Fe与足量稀HNO3反应,转移3 NA个电子
参考答案:D
本题解析:
试题分析:A、苯分子中不存在碳碳双键,错误;B、常温常压下、22.4LCO2的物质的量不是1mol,错误;D、次氯酸钠是强碱弱酸盐,溶于水水解,则1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目小于NA,错误;D、硝酸过量,将铁氧化为铁离子,所以1 mol Fe与足量稀HNO3反应,转移3 NA个电子,正确,答案选D。
考点:考查阿伏伽德罗常数的计算
本题难度:一般