微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 KIO3为白色结晶粉末,溶于水,常温下稳定,833K以上分解.目前KIO3的制备方法有两种:
方法一:电解法.工艺流程如下:
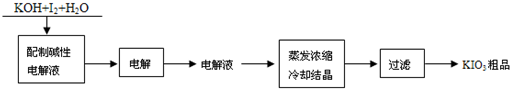
(1)配制碱性电解液的过程中,I2会发生氧化还原反应,生成KIO3和______(填化学式).
(2)电解时,阳极和阴极的电极方程式分别是:
①阳极:______;②阴极:______.
方法二:氯酸钾氧化法.在酸性条件下,将氯酸钾(KClO3)与I2混合,反应后得到KH(IO3)2,再用KOH中和即得KIO3.有关化学反应方程式为:6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2
(3)KClO3氧化过程中,还原产物为______;每生成6mol?KH(IO3)2,反应中转移的电子为______mol.
(4)与“电解法”相比,“氯酸钾氧化法”的不足之处是(写出两条):
①______②______.
参考答案:(1)由I2会发生氧化还原反应,生成KIO3,I元素的化合价
本题解析:
本题难度:一般
2、选择题 有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
A.氧化剂和还原剂的物质的量之比为1:8
B.该过程说明Fe(NO3)2溶液不宜加酸酸化
C.每1molNO3-发生氧化反应,转移8mole-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列说法正确的是( )
A.酸性氧化物就是非金属氧化物
B.纯净物与混合物的区别是看是否只含有一种元素
C.强弱电解质的区别是溶液的导电能力的大小
D.氧化还原反应的判断依据是反应过程中元素的化合价是否发生变化
参考答案:D
本题解析:
本题难度:一般
4、选择题 已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反.在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
A.Al2S3、FeS和S
B.Fe(OH)3和Al(OH)3
C.Fe2S3和Al(OH)3
D.FeS、Al(OH)3和S
参考答案:在Fe2(SO4)3和AlCl3溶液中加过量KI,先是Fe2
本题解析:
本题难度:一般
5、简答题 部分含硫物质如图1所示,其中H2S和X是大气污染物.这些物质之间的相互转化为工业生产和处理环境问题提供了理论支持.
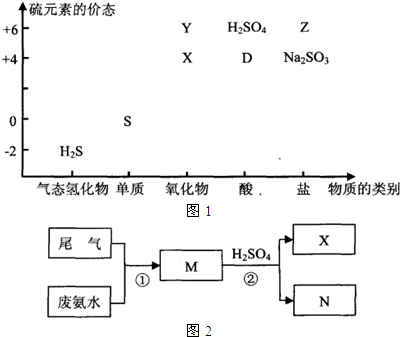
(1)已知Na2SO3可发生下列过程:X
①OH-
H+
Na2SO3→Z,其中反应①的离子方程式是______.若欲将X转化成“安全物质”Z,使其对环境的影响最小,需加入______(填字母).
a.氧化剂????b.还原剂????c.酸性物质????d.碱性物质
(2)为了减少向大气排放X,不同企业采取不同的措施.
方法一:向含硫煤中加入适量石灰石,可将X转化为含钙的“安全物质”,减少其排放所造成的污染,该过程的化学方程式是______.
方法二:如图2是用废氨水回收含有低浓度X工业尾气的流程示意图.请回答下列问题:
M的化学式是______;
此法处理尾气的优点是______,______.
参考答案:(1)由过程可知,X与碱反应生成亚硫酸钠,则X为二氧化硫,则
本题解析:
本题难度:一般