微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (18分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe?3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是???????????????????;X与过量浓硝酸反应后溶液中含有的盐的化学式为????????????????。
(2)某溶液中有Mg2+、Fe2 +、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐
+、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐 酸中,所得溶
酸中,所得溶 液与原溶液相比,溶液中大量减少的阳离子是????????????????;
液与原溶液相比,溶液中大量减少的阳离子是????????????????;
A.Mg2+???????????????B.Fe2+????????????????????C.A13+????????????????????D.Cu2+
(3)氧化铁是重要工业颜料,用废秩屑制备它的流程如下:

回答下列问题:
①操作I的名称是???????????,操作II的名称是???????????????????;操作III的
方法为???????? ?????????????????????????。
?????????????????????????。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)???????????????;
③请完成生成FeCO3沉淀的离子方程式???????????????????。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定
(5Fe2++MnO-4+8H+====5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需????????。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是????????。
A.稀硝酸???? B.稀盐酸??????? C.稀硫酸????????? D.浓硝酸
③某同学设计的下列滴定方式,最合理的是?????。(夹持部分略去)(填字母序号)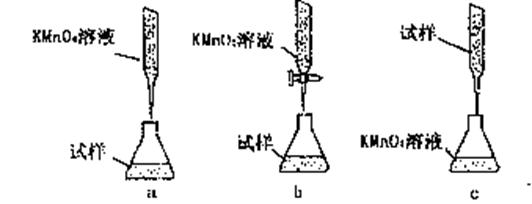
参考答案:[(1)Fe2+、Fe3+、H+;Fe(NO3)2;(每空2
本题解析:略
本题难度:简单
2、选择题 某CuO粉末与适量的硫酸(ρ=1.7g·cm-3)在微热下充分反应,冷却后恰好全部形成CuSO4·5H2O(设反应过程中无水份损失)。则此硫酸溶液的物质的量浓度为
A.8.5mol·L-1
B.10.0mol·L-1
C.17.0mol·L-1
D.18.4mol·L-1
参考答案:B
本题解析:CuO与硫酸反应的方程式为: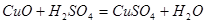 ,设CuO物质的量为1mol,则需硫酸物质的量为1mol,由于反应冷却后恰好全部形成CuSO4·5H2O,即可知所取硫酸溶液中含有4 mol水;则所取硫酸溶液的体积为
,设CuO物质的量为1mol,则需硫酸物质的量为1mol,由于反应冷却后恰好全部形成CuSO4·5H2O,即可知所取硫酸溶液中含有4 mol水;则所取硫酸溶液的体积为 本题难度:一般
本题难度:一般
3、填空题 (10分)铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为______________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是__________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO===3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是_ _______(填字母)。
_______(填字母)。
选项
| 陈述Ⅰ
| 陈述Ⅱ
| 判断
|
A
| 铁是地壳中含量最高的
金属元素
| 铁是人类最早使用的金属材料
| Ⅰ对;Ⅱ对;有
|
B
| 常温下铁与稀硫酸反应
生成氢气
| 高温下氢气能还原氧化
铁得到铁
| Ⅰ对;Ⅱ对;无
|
C
| 铁属于过渡元素
| 铁和铁的某些化合物可用作催化剂
| Ⅰ错;Ⅱ对;无
|
D
| 在空气中铁的表面能形
成致密的氧化膜
| 铁不能与氧气反应
| Ⅰ对;Ⅱ对;有
参考答案: 本题解析:略 本题解析:略
本题难度:一般
4、选择题 已知在溶液中发生反应:2Fe3+ + Cu=2Fe2+ + Cu2+,现有Fe、Cu、Fe2O3三者组成的混合物共mg,恰好溶解在100 mL 1. 00 moL/L的盐酸中。下列判断一定正确的是[???? ]
A.Fe2O3的质量范围不能确定
B.m的值不能确定
C.反应中可观察到大量气泡产生
D.向反应后的溶液滴加KSCN溶液不显血红色
参考答案:B
本题解析:
本题难度:一般
5、计算题 Fe与Fe2O3的混合物2.72g,加入到50mL 1.6mol/L盐酸中恰好完全溶解,经KSCN检验,溶液不显红色,若忽略溶液体积变化,写出反应的离子方程式?????????, ??????????????,?????????????。
反应后溶液中Fe2+物质的量浓度是????????????mol/ L
参考答案:(离子方程式各1分) Fe + 2H+ ="==" Fe2+
本题解析:略
本题难度:一般
|