微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质中,都能与盐酸反应放出气体,并且后者与盐酸反应比前者与盐酸反应放出气体更迅速的是(溶液的浓度均相同)(???)
A.Na2CO3和NaHCO3
B.Na和Mg
C.KHCO3和K2CO3
D.Si和Al
参考答案:A
本题解析:金属越活泼(还原性越强)与酸反应越剧烈;碳酸的酸式盐阴离子只需结合一个H+生成CO2和H2O,而其正盐需结合两个H+生成CO2和H2O,所以反应放出气体后者比前者缓慢;Si不与盐酸反应。
本题难度:简单
2、选择题 下列情况下,两种物质不发生反应的是(???)
A.二氧化硅放入浓硫酸中
B.二氧化硅与纯碱混合加热
C.二氧化硅与碳在高温下混合
D.二氧化硅放入氢氟酸溶液中
参考答案:A
本题解析:二氧化硅与纯碱或碳在高温下混合都能反应,二氧化硅与氢氟酸常温下就能反应,但二氧化硅不能与浓硫酸反应。故选A项。
本题难度:简单
3、选择题


A.阴离子化学式为:Si6O1812—
B.绿柱石可用氧化物形式表示为:3BeO·Al2O3·6SiO2
C.绿柱石可表示为Be3Al2[Si3O12]
D.绿柱石可溶于强碱和氢氟酸
参考答案:C
本题解析:本题考查硅酸盐的结构、性质和表示方法,较难题。解题关键是由阴离子部分的结构图解读出其原子组成和所带电荷数。阴离子里共有6个SiO44—单元,但其中有6个氧原子是共用的,故氧原子总数为4×6–6=18个,根据O和Si的化合价可计算出该阴离子带有12个负电荷,故其化学式为Si6O1812—,A正确;再根据电荷守恒(或化合价代数和为零)可推出该硅酸盐的化学式为Be3Al2[Si6O18],也可用氧化物的形式表示为3BeO·Al2O3·6SiO2,故B对C错;硅酸盐一般可与强碱反应,也能与HF反应,D也正确。
本题难度:一般
4、填空题 (1)钟乳石和石笋的主要成分是碳酸钙,其形成过程如右图所示。随着旅游人数的增加,潮湿溶洞中的钟乳石和石笋受到二氧化碳侵蚀,其化学方程式为:__________________________________。
(2)某学生提出一个修复溶洞底部受损石笋的研究方案,由以下五步组成,正确的实验步骤依次是__________。
①将盛有碱溶液的容器置于石笋的上部②配制一定浓度的碱溶液③选择合适的碱④调节碱溶液下滴的速度⑤观察石笋表面复原情况
参考答案:(1)CaCO3+CO2 + H2O 本题解析:从图可见,石笋受损是由于地表水中溶有CO2,CO2可溶解石笋,生成Ca(HCO3)2,而Ca(HCO3)2在受热的情况下会分解生成CaCO3,形成钟乳石和石笋。修复溶洞底部受损的石笋应用能与Ca(HCO3)2反应的碱。故实验的第一步是选择合适的碱,再配制一定浓度的碱溶液后进行修复操作①④⑤。
本题解析:从图可见,石笋受损是由于地表水中溶有CO2,CO2可溶解石笋,生成Ca(HCO3)2,而Ca(HCO3)2在受热的情况下会分解生成CaCO3,形成钟乳石和石笋。修复溶洞底部受损的石笋应用能与Ca(HCO3)2反应的碱。故实验的第一步是选择合适的碱,再配制一定浓度的碱溶液后进行修复操作①④⑤。
本题难度:一般
5、实验题
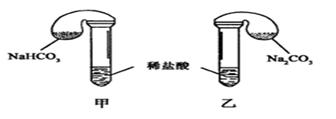
请回答:
(1)各组反应开始时,???装置中的气球体积先变大,该装置中反应的离子方程式是______。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
组
数
| 试剂用量
| 实验现象
(气球体积变化)
| 分析原因
|
?
①
| 0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸
| 甲中气球与乙中气球的体积相等
| 甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2)
|
?
②
| 0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸
| 甲中气球比乙中气球的体积大
| ?
|
?
③
| 0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸
| 甲中气球比乙中气球的体积大
| ?
|
片刻后,乙中气球又缩小,甲中气球的体积基本不变
| (用离子方程式表示)
?
参考答案:(1)甲??? HCO3-+H+=CO2 ↑+H2O????
本题解析:(1)根据化学方程式计算可知第①组中NaHCO3和Na2CO3都已完全反应。对比第①组数据知第②组中盐酸一定过量,NaHCO3和Na2CO3一定完全反应,且NaHCO3产生的CO2比Na2CO3的多。第③组中,n(Na2CO3)=0.0057mol,n(NaHCO3)=0.0071mol,n(HCl)=0.006mol。把Na2CO3缓慢加入到盐酸中,在盐酸反应完以前,盐酸是过量的而Na2CO3是少量的。因此开始发生的反应是:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据化学方程式,有:Na2
本题难度:简单
|