微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10?mL?0.01?mol·L-1?NaHC2O4溶液中滴加0.01?mol·L-1?NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2 mol·L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
参考答案:D
本题解析:草酸氢钠溶液显酸性,说明草酸氢钠的电离程度大于其水解程度。因为草酸是弱电解质,所以0.01 mol·L-1 NaHC2O4溶液中,氢离子的浓度小于0.01mol/L,A不正确。加入氢氧化钠发生的反应为NaOH+NaHC2O4==Na2C2O4+H2O,二者恰好反应时,消耗氢氧化钠10ml。生成物草酸钠水解,溶液显碱性,C不正确。如果氢氧化钠的体积小于10ml,则二者反应后,溶液就有可能显中性。根据电荷守恒c(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-)可知,如果溶液显中性,则c(Na+)=2c(C2O42-)+c(HC2O4-),因此B也是不正确的。当氢氧化钠大于10ml时,溶液中含有氢氧化钠和草酸钠两种溶质,由于草酸钠的水解以第一步水解为主,且氢氧化钠的存在会抑制其水解,因此选项D是正确的。答案选D。
本题难度:困难
2、选择题 已知0.1mol/L的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA—)+c(OH—)+2c(A2—)
D.在Na2A溶液中一定有:c(Na+)>c(A2—)>c(H+)>c (OH—)
参考答案:C
本题解析:试题分析:A不正确,因为酸是弱酸,两种盐都水解,离子种类相同;B不正确,根据水解方程式A2-+H2O HA-+OH-、HA-+H2O
HA-+OH-、HA-+H2O![]() H2A+OH-可知,前者阴离子个数是增加的,所以在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数前者多;C正确,符合电荷守恒;D不正确,因为水解溶液显碱性,答案选C。
H2A+OH-可知,前者阴离子个数是增加的,所以在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数前者多;C正确,符合电荷守恒;D不正确,因为水解溶液显碱性,答案选C。
考点:考查水解的应用和有关判断以及离子浓度大小比较
点评:该题是中等难度的试题,也是高考中的常见题型。试题综合性强,注重解题的灵活性,侧重对学生方法的指导与训练。该题的关键是理解水解原理,以及利用好溶液中离子浓度的各种守恒关系。
本题难度:一般
3、选择题 将一小块铝箔放在酒精灯上加热至熔化,下列实验现象描述正确的是
A.铝箔熔化,失去光泽
B.铝箔燃烧,发出耀眼的白光
C.铝箔熔化,火星四溅
D.铝箔燃烧,有黄色火焰
参考答案:A
本题解析:铝在空气中很快形成致密的氧化膜,保护内层的金属不被进一步氧化,在空气中受热时铝箔熔化,但并没有滴落下来,并且也不会有燃烧、发光等现象.
本题难度:一般
4、选择题 在80 ℃时,水的离子积KW=3.8×10-13,该温度时纯水的pH
A.等于7
B.小于7
C.大于7
D.无法确定
参考答案:B
本题解析:纯水呈中性,c(H+)=c(OH-),即使升温至80 ℃时,仍为c(H+)=c(OH-),所以有KW=c(H+)·c(OH-)=[c(H+)]2=3.8×10-13,c(H+)=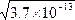 ?mol·L-1=6.16×10 -6 mol·L-1,所以选B。
?mol·L-1=6.16×10 -6 mol·L-1,所以选B。
本题难度:一般
5、选择题 下列现象或事实可以用同一原理解释的是
A.氯水和活性炭使红墨水褪色
B.浓硫酸和浓硝酸长期暴露在空气中浓度降低
C.漂白粉和水玻璃长期暴露在空气中变质
D.SO2使品红溶液和酸性高锰酸钾溶液褪色
参考答案:C
本题解析:氯水使红墨水褪色是氧化性漂白的结果,活性炭使红墨水褪色是物理吸附的结果.浓硫酸吸水使其浓度降低,浓硝酸易挥发使其浓度降低.SO2使品红溶液褪色表现了SO2的漂白性,使酸性高锰酸钾溶液褪色表现了其还原性.
本题难度:一般