3470
(1)操作1、3是相同操作,其名称是?????????????????????。
(2)操作2中要在HCl气体的氛围内加热的原因是??????????????????????。
(3)电解制镧的尾气要用碱液吸收,请写出反应的离子方程式?????????????。
(4)真空、高温过程中的反应方程式为???????????????????????????????。

(5)粗镧精制过程中温度控制范围?????????????????????????????。
(6)重熔蒸馏制得的镧中仍然混有及少量的钙。某批次产品69.709g,经分析含钙0.209g,该产品的等级为???????????????????????(化工产品等级标准:优级纯≥99.8﹪,分析纯≥99.7﹪,化学纯≥99.5﹪).
参考答案:(1)过滤;(2)防止LaCl3水解;(3)Cl2+2OH-
本题解析:
试题分析:(1)操作1、3是相同操作,都是分离难溶性固体与液体混合物的方法,其名称是过滤。(2)从LaCl3溶液中获得LaCl3固体,由于该盐是强酸弱碱盐,容易发生水解反应,所以为了防止其水解,操作2要在HCl气体的氛围内加热。(3)2LaCl3 2La+ 3Cl2↑.在尾气中含有氯气,要用碱液吸收,该反 2La+ 3Cl2↑.在尾气中含有氯气,要用碱液吸收,该反
本题难度:一般
2、选择题 Na2CO3水溶液中存在CO32-?+?H2O HCO3-?+OH-平衡。下列说法不正确的是 [???? ] HCO3-?+OH-平衡。下列说法不正确的是 [???? ]
A.稀释溶液,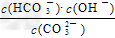 增大?????? 增大??????
B.通入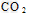 ,溶液pH减小 ,溶液pH减小
C.升高温度,此平衡常数增大????????????
D.加入NaOH固体,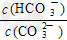 减小 减小
参考答案:A
本题解析:
本题难度:一般
3、填空题 室温下,0.1mol/L的醋酸溶液的PH约为3,当向其中加入醋酸钠晶体溶解后发现溶液的PH变大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大,因而溶液的PH增大;乙同学认为醋酸钠溶于水电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的PH增大。
(1)上述解释中????(填“甲”或“乙”)正确。
(2)为验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸中加入少量下列物质中的_____,然后测定溶液的PH值。
A.固体CH3COOK
B.固体CH3COONH4
C.NH3气体
D.固体NaHCO3
(3) 若_____(填“甲”或“乙”)的解释正确,溶液的PH应_____(填“增大”、“减小”或“不变”)
(4)常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有??????种粒子
②溶液中有两种粒子的物质的量之和一定等于0.01mol,它们是?????和??????????
③溶液中n(CH3COO-)+ n(OH-)-n(H+)= ??????????????
参考答案:(1)乙⑵ B?⑶乙、增大?⑷① 7?②CH3COO-? C
本题解析:
(1)(2)(3)由题意知,溶液中存在两个平衡:CH3COOH CH3COO-+H+,CH3COO-+H2O CH3COO-+H+,CH3COO-+H2O
本题难度:简单
4、选择题 0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是(??? )
A.c(K+)+c(H+)=c(S2—)+c(HS—)+c(OH—)
B.c(K+)+ c(S2—) = 0.3mol/L
C.c(K+)=c(S2—)+c(HS—)+c(H2S)
D.c(OH-)=c(H+)+c(HS—)+2c(H2S)
参考答案:D
本题解析:
试题分析:A不正确,不符合电荷守恒,应该是c(K+)+c(H+)=2c(S2—)+c(HS—)+c(OH—);B和C都不正确,不符合物料守恒,分别应该是c(K+)+ c(S2—)+c(HS—)+c(H2S) = 0.3mol/L、c(K+)=2c(S2—)+2c(HS—)+2c(H2S);D正确,符合质子守恒,答案选D。
点评:判断溶液中离子浓度关系的关键是掌握几个守恒关系式,即电荷守恒、物料守恒和质子守恒。
本题难度:一般
5、选择题 将等体积的0.1 mol·L-1 KHSO4溶液逐滴加入0.1 mol·L-1的Na2SO3溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中不正确的是
A.c(SO)>c(SO)>c(H+)>c(OH-)
B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=c(SO)+c(H2SO3)+c(HSO)+c(SO)
D.c(Na+)+c(K+)+c(H+)=2c(SO)+c(HSO)+c(OH-) +2c(SO)
参考答案:A
本题解析:H++SO32-=HSO3-,恰好完全反应,此时是0.1molSO42-和0.1molHSO3-的溶液,因为所得溶液能使紫色石蕊试液变红,溶液显酸性,HSO3-的电离程度大于水解程度,
A.错误,应为:c(SO)>c(H+)>c(SO)>c(OH-)
B 正确,由题意可知,钠离子浓度为0。2 mol·L-1,价钾离子浓度为0.1 mol·L-1,溶液显酸性,氢离子浓度大于氢氧根离子浓度
C正确,遵循物料守恒c(SO)+c(H2SO3)+c(HSO)="0.1" mol·L-1,c(SO)
本题难度:一般
|