微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在溶液中可以大量共存,加OH-产生沉淀,加H+生成气体的一组离子是( )
A.Na+、Cu2+、CO32-、Cl-
B.Na+、Cl-、HCO3-、Mg2+
C.Cl-、NO3-、K+、Ca2+
D.NH4+、K+、H+、SO42-
参考答案:A、Cu2+与CO32-反应生成沉淀而不能大量共存,故A错误
本题解析:
本题难度:简单
2、填空题 (11分)2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
A.2F2+2H2O=4HF+O2
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为: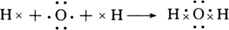
(2)①pH=1的溶液呈酸性,各离子互不反应,可以大量共存;②酸性溶液中,NO3?、H+与Fe2+发生氧化还原反应,不能大量共存;③各离子互不反应,可以大量共存;④HCO3?与H+反应,不能大量共存。
(3)A、2F2+2H2O=4HF+O2, 依据化合价变化,水中O元素化合价升高,水做还原剂;B、2Na2O2+2H2O=4NaOH+O2↑,据化合价变化,此反应是过氧化钠的自身氧化还原反应,水既不是氧化剂也不是还原剂;C、CaH2+2H2O=Ca(OH)2+2H2↑,依据化合价变化,水中的氢元素化合价降低,水做氧化剂;D、3Fe+4H2O(g) Fe3O4+4H2,依据化合价的变化,水中的氢元素化合价降低,水做氧化剂;所以水仅做氧化剂的是CD,水既不做氧化剂又不做还原剂的是B。
Fe3O4+4H2,依据化合价的变化,水中的氢元素化合价降低,水做氧化剂;所以水仅做氧化剂的是CD,水既不做氧化剂又不做还原剂的是B。
(4)负极上H2失去电子,电极方程式为:H2+2OH?—2e?=2H2O;H2O的密度约为100g/L,所以1.8 L H2O的物质的量为:1800g÷18g/mol=100mol,根据电池总反应2H2+O2=2H2O可得对应关系:H2O ~ 2e?,所以电子转移为200mol,数目为200NA。
考点:本题考查电子式、离子共存、氧化还原反应原理、原电池原理。
本题难度:一般
3、选择题
A.I-、AlO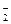 、Cl-、CO
、Cl-、CO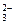
B.Na+、K+、NH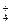 、Ba2+
、Ba2+
C.Br-、S2-、Cl-、CO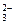
D.SO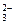 、NO
、NO 、SO
、SO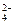 、HCO
、HCO
参考答案:AC
本题解析:NH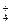 +OH-===NH3·H2O? HCO
+OH-===NH3·H2O? HCO +OH-===CO
+OH-===CO 本题难度:一般
本题难度:一般
4、选择题 下列离子组合,能够大量共存的是
A.酸性溶液中:Al3+、Fe3+、SO42-、SCN-
B.透明溶液中:MO4-、K+、Na+、NO3-
C.加入铝粉后产生氢气的溶液中:Ba2+、K+、NO3-、Al3+
D.强酸性溶液中:Na+、Fe2+、SO42-、NO3-
参考答案:B
本题解析:A选项中Fe3+与SCN-要形成络合物而不能共存。C选项中加入铝粉后产生氢气的溶液可能是酸性溶液,也可能是碱性溶液,如果是碱性溶液,那么Al3+要与OH-反应生成偏铝酸根离子。D选项中因为是强酸性溶液,NO3-在酸性溶液中表现出强氧化性,可以将Fe2+氧化成Fe3+,因此也不能共存。
本题难度:一般
5、选择题 常温下,下列各组离子一定能大量共存的是(??)。
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13 mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、I-、Cl-、NO3-
参考答案:B
本题解析:A项,Fe3+和SCN-能形成络合物,所以不能大量共存;C项,溶液显碱性,所以NH4+和Al3+都不能大量存在;D项,NO3-在酸性环境中具有强氧化性,可以将I-氧化。
本题难度:一般