微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)合成气是以H2、CO等为主要组成的供化学合成的原料气,回答有关问题:
(1)甲烷在一定条件下与水反应可得合成气,该反应中每转移1.2mol电子,所得合成气在表况下的体积为??????????L。
(2)合成气在合成氨气时需除去CO,可利用以下反应: CO(g)+H2O(g) CO2(g)+H2(g)?
CO2(g)+H2(g)?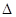 H=-41.16kJ/mol,对于该反应有关表述正确的是????????????????。
H=-41.16kJ/mol,对于该反应有关表述正确的是????????????????。
a.其他条件不变,缩小体系体积增大压强时反应速率不变,所以平衡不移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.温度升高,该反应平衡常数增大
d.为提高CO转化率,可适当增加水蒸气用量
某温度下,H2O和CO按体积比5:l充入某恒容反应器,平衡时测得CO与CO2体积比l:9,则该条件下的平衡常数为??????????????????????????(保留两位有效数字)
(3)为除去(2)中生成的CO2,可用碳酸钾溶液吸收,常温下pH=10的碳酸钾溶液中水电离的OH- 的物质的量浓度为?????????,碳酸氢钾溶液中离子浓度大小顺序为????????????????
(4)CO2和NH3在一定条件下反应生成尿素[CO(NH2)2]:CO2(g)+2NH3(1)=H2O(1)+CO(NH2)2(1),CO2的转化率随温度变化曲线如下,则该反应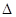 H ???????0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理??????????????????。
H ???????0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理??????????????????。
参考答案:(14分,每空2分)(1)17.92L
(2)b d?
本题解析:(1)甲烷在一定条件下与水反应的方程式为CH4+H2O→CO+3H2,即每生成4mol气体反应中就转移6ml电子。反应中每转移1.2mol电子,所得合成气在标准状况下的体积为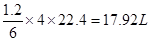 。
。
(2)缩小体系体积增大压强,则反应速率一定会增大,但反应前后气体的体积不变,故改变越强不影响平衡,a不正确。绝热条件下,若测得该
本题难度:一般
2、实验题 某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。?
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。?
名称
| 托盘天平
(带砝码)
| 小烧杯
| 坩埚钳
| 玻璃棒
| 药匙
| 量筒
|
仪器
| 
| 
| 
| 
| 
| 
|
序号
| a
| b
| c
| d
| e
| f
?
Ⅱ.测定中和热
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、盐酸、NaOH溶液,尚缺少的实验玻璃用品是 。?
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验
次数
| 起始温度t1/℃
| 终止温度
t2/℃
| 温度差平均值
(t2-t1)/℃
| H2SO4
| NaOH
| 平均值
| 1
| 26.2
| 26.0
| 26.1
| 30.1
| ?
| ?
| 2
| 27.0
| 27.4
| 27.2
| 33.3
| ?
| 3
| 25.9
| 25.9
| 25.9
| 29.8
| ?
| 4
| 26.4
| 26.2
| 26.3
| 30.4
| ?
?
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=“4.18”J/(g·℃)。则中和热ΔH= (取小数点后一位)。?
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。?
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
参考答案:Ⅰ.(1)10.0 (2)abe
Ⅱ.(1)环形玻璃搅
本题解析:考查一定物质的量浓度溶液的配制、中和热的测定以及误差分析等
Ⅰ.(1)由于没有470 mL的容量瓶,所以应该配制500 mL 0.50 mol·L-1NaOH溶液。所以需要氢氧化钠的质量是500 mL×10-3×0.5 mol/L×40 g/mol="10.0" g。
(2)氢氧化钠具有腐蚀性和吸水性,所以应该放在烧杯中称量,同时还需要药匙取NaOH固体,所以正确的答案选abe。
Ⅱ.(1)在中和热的测定实验中,溶液是需要搅拌的,所以还缺少环形玻璃搅拌棒。
(2)①四次实验的温度差
本题难度:一般
3、简答题 关于化学反应与能量的说法中正确的是( )
A.化学反应的反应热与反应的路径有关
B.反应热包括燃烧热、中和热、溶解热等
C.凡经过加热而发生的化学反应都是吸热反应
D.酸碱中和反应属于吸热反应
参考答案:A、根据盖斯定律,反应热的大小只和反应的始态、终态有关,和反
本题解析:
本题难度:一般
4、选择题 下列过程中,需要吸收能量的是
A.H+H=H2
B.H+Cl=HCl
C.I2→I+I
D.S+O2=SO2
参考答案:C
本题解析:断键需要吸热,即分子变成原子是吸热过程,而原子形成分子的过程则是放热的,C正确。其余都是放热过程,答案选C。
本题难度:简单
5、选择题 已知: C(s)+1/2 O2(g_)=CO(g);△H1=" -110.35" kJ/mol
CO(g)+1/2 O2(g)=CO2(g);△H2=" -282.57" kJ/mol
则:C(s)+O2(g)=CO2(g);△H3=
A.+172.22 kJ/mol
B.-172.22 kJ/mol
C.+392.92 kJ/mol
D.-392.92 kJ/mol
参考答案:D
本题解析:略
本题难度:简单
|
|