微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分,每空2分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②取一滴定管依次用自来水、蒸馏水洗净后,马上注入0.01mol·L-1Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3="2NaI+" 2Na2S4O6试回答下列问答:
(1)步骤①加入的指示剂是 。
(2)步骤②应使用 式滴定管。
(3)判断达到滴定终点的实验现象是 ;
(4)氯的实际浓度比所测浓度会偏小,造成误差的原因是
(5)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
参考答案:淀粉溶液;碱;滴入最后一滴标准液,溶液由蓝色变成无色且半分钟
本题解析:
试题分析:本滴定实验为利用I2+2Na2S2O3="2NaI+" 2Na2S4O6测定生成I2从而确定水样中的Cl2,故所用指示剂用来指示溶液中I2的量,故应用淀粉溶液作指示剂;步骤②中滴定管所装溶液为Na2S2O3,溶液呈碱性,故应用碱式滴定管;判断达到滴定终点的实验现象是滴入最后一滴标准液,溶液由蓝色变成无色且半分钟内不恢复;步骤②中洗涤滴定管应用水洗后再用Na2S2O3溶液润洗,该步骤没有润洗故会导致所装标准液Na2S2O3溶液浓度变小,故消耗体积变大,故会导致所测水样中Cl2浓度偏大;(5)中依据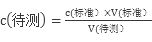 可知A项酸式滴定管未用标准盐酸溶液润洗会导致c(标准)变小,则V(标准)偏大故所测NaOH溶液浓度偏大;锥形瓶不能用待测液润洗,故B项不会产生影响;C项滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了则会导致V(标准)包含气泡体积偏大,故会导致所测浓度偏大;滴定时将标准液溅出锥形瓶外会导致V(标准)偏大故所测NaOH溶液浓度偏大。
可知A项酸式滴定管未用标准盐酸溶液润洗会导致c(标准)变小,则V(标准)偏大故所测NaOH溶液浓度偏大;锥形瓶不能用待测液润洗,故B项不会产生影响;C项滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了则会导致V(标准)包含气泡体积偏大,故会导致所测浓度偏大;滴定时将标准液溅出锥形瓶外会导致V(标准)偏大故所测NaOH溶液浓度偏大。
考点:滴定实验操作。
本题难度:一般
2、选择题 甲溶液的pH=6,乙溶液的pH=2,则下列叙述正确的是( )
A.甲、乙两溶液的c(H+)之比为400:1
B.甲中水的电离程度与乙中水的电离程度无法比较
C.甲中水的电离程度小于乙中水的电离程度
D.甲、乙两溶液均呈酸性
参考答案:B
本题解析:略
本题难度:一般
3、选择题 大米的酸碱度是 ( )
A.中性食品
B.碱性食品
C.弱碱性食品
D.酸性食品
参考答案:D
本题解析:
大米主要成分是淀粉,淀粉被水解成糖类,糖类(淀粉属于多糖)一般都是酸性的。
点评:考查食物的酸碱性问题。注意是代谢后的产物酸碱性来考虑,而非食物的酸碱性。含氮硫的食物,一般为酸性食物;含钾、钙的食物,一般为碱性食物。
本题难度:简单
4、选择题 纯水在80℃时的PH [???? ]
A.等于7
B.大于7
C.小于7
D.无法确定
参考答案:C
本题解析:
本题难度:简单
5、填空题 (16分)Ⅰ、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨三角漏斗。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是 (全对得分,下同)
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是 。
(3)过滤时,应选用上述仪器中的 (填编号)
Ⅱ、为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点的现象为 。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ (填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为
mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是 。
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c (HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L
C.c(H+)<c(OH-)
D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
参考答案:Ⅰ、(1)蒸馏水和指示剂; (2)250mL容量瓶和胶头滴管
本题解析:
试题分析:Ⅰ(1)做酸碱中和滴定时,需要酸碱指示剂判断滴定终点,用蒸馏水润洗滴定管;(2)配制一定浓度的溶液需要在250m容量瓶中进行,定容时用胶头滴管;(3)过滤时,应选用①铁架台(含铁圈)、④烧杯、⑤玻璃棒、⑦滤纸、⑨三角漏斗;Ⅱ、KMnO4具有氧化性,溶液应装在算式滴定管中;(1)滴加最后一滴KMnO4后,锥形瓶中溶液从无色突变为紫红色,且半分钟内颜色不恢复,达到滴定终点;(2)没用标准液洗涤滴定管,会消耗高锰酸钾的体积增大,故草酸溶液的物质的量浓度偏高;(3)前后的两次读数分别为a和b,消耗高锰酸钾的体积为(b-a)mL,测得草酸溶液的物质的量浓度为0.1c(b-a) mol/L ;(4)根据电荷守恒,c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故A错误;c (HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L,符合物料守恒,故B正确;HC2O4—电离出C2O42—,又能水解出H2C2O4,c(C2O42-)>c(H2C2O4),说明电离大于水解,所以溶液呈酸性,C错误;c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),符合物料守恒,故D正确。
考点:本题考查中和滴定、物料守恒。
本题难度:困难