微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 9.7 g Cu和Zn的合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2.24 L,将溶液稀释为1 L,测得溶液的pH=1,此时溶液中NO3-的浓度为(??)
A.0.3 mol·L—1
B.0.4 mol·L—1
C.0.5 mol·L—1
D.0.6 mol·L—1窗体底端
参考答案:B
本题解析:2.24 L标准状况下的NO气体,其物质的量为0.1mol,在反应的过程中转移0.3mol电子,设】9.7 g Cu和Zn的合金中铜的物质的量为xmol锌的物为ymol,则
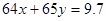 ;
; 本题难度:一般
本题难度:一般
2、选择题 能证明氮元素比磷元素非金属性强的事实是(??? )
A.氮气在常温下是气体,而磷单质是固体
B.N2在空气中不能燃烧,而磷能在空气中燃烧
C.NH3极易溶于水,而PH3难溶于水
D.NH3在空气中不可燃,而PH3可燃
参考答案:D
本题解析:N2不能在空气中燃烧是因为N2分子稳定性比磷强,不表明氮元素比磷元素活泼性差。NH3在空气中比PH3难反应,表明反应时磷元素比氮元素更易与氧结合,则磷元素非金属性比氮元素弱。
本题难度:简单
3、实验题 (12分)某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:
(Ⅰ)NH3的制取及收集
1.写出实验制取氨气的化学方程式????????????;
2.收集氨气的方法是????????????????????????。
(II)HCl的制取及收集
实验室通常以反应:2NaCl(晶体)+H2SO4(浓)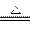 Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
1.实验室制取HCl气体可选择下列装置中的

A.实验室制氧气的装置
B.实验室制氢气的装置
C.实验室制二氧化碳的装置
D.实验室制氯气的装置
(III)验证氨气部分性质的探究实验:
为了同时进行氨气溶于水以及氨气与HCl的反应的探究,同学们积极思考并设计了如下的实验装置图。首先在甲、乙两个干燥的圆底烧瓶中分别收集满了NH3和HCl气体,然后再按如下图所示连接好各个装置(活塞a和b均处于关闭状态),并按以下步骤进行实验:
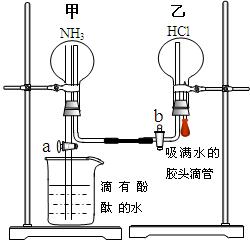
1.先挤压胶头滴管再打开活塞b,请你预测此时乙中可能观察到的现象是:?? ?????????。
?????????。
发生反应的方程式为:?????????????????????????????????????????。
2.待乙中观察到明显现象后立 即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是:?????????????????????????????????????????。
即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是:?????????????????????????????????????????。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
4、填空题 (6分)工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g—0.5g。已知NaNO2能发生如下反应:aNO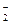 +xI-+yH+=bNO↑+cI2+zH2O,
+xI-+yH+=bNO↑+cI2+zH2O,
请回答下列问题:
(1)上述反应中,x、y、z的数值分别是??????????????????(全对才给分)。
(2)根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐
和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为???
????????????????????。
(3)某工厂废切削液中含有2%—5%的NaNO2,直接排放会造成水污染,但加
入下列物质中的某一种就能使NaNO2转化为不引起污的N2,该物质是?????,
a.NaCl??????????? b.H2O2???????????????????????c.NH4Cl??????????? d.浓H2SO4
所发生反应的离子方程式为:?????????????????????????????????????。
参考答案:(1)2, 4, 2?(3分)(2)食醋?(1分)
(
本题解析:略
本题难度:一般
5、填空题 (15分)硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程:
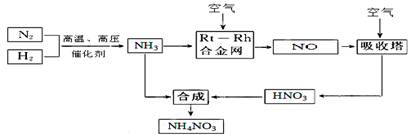
回答下列问题:
(1)N2的电子式????????????,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 ?????????????????????????????????????????。
(2)氨催化氧化的化学方程式是??????????????????????????????????????,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响??????????????????。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法????????????????????????????????????。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答)?????????????。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将???(填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为???????????????(25℃时,Kb(NH3·H2O)="2.0" × 10-5?mol·L-1)。
参考答案:(1)? 本题解析:
本题解析:
试题分析:(1)在氮气分子中两个N原子共用三对电子,所以N2的电子式是 ;根据题意可得合成氨气的反应的热化学方程式为N2(g)+3H2 (g)
;根据题意可得合成氨气的反应的热化学方程式为N2(g)+3H2 (g)  本题难度:一般
本题难度:一般