微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的是
① ??????????????②
??????????????②
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-) > c(NH4+) > c(H+) > c(OH-)
A.①④
B.②③
C.①③
D.②④
参考答案:D
本题解析:①ω=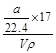 ③加入等体积的水,质量要大于等体积的氨水,混合后的质量分数小于0.5ω。
③加入等体积的水,质量要大于等体积的氨水,混合后的质量分数小于0.5ω。
本题难度:一般
2、选择题 给出下列条件,无法确定该物质摩尔质量的是
A.已知气体在标准状况时的密度
B.已知物质的体积和质量
C.已知一定量物质的质量和物质的量
D.已知物质一个分子的实际质量
参考答案:B
本题解析:
试题分析:A.标况下,气体摩尔体积是22.4L/mol,公式ρ=M/Vm中,密度和气体摩尔体积已知,所以能计算出其摩尔质量,故A不选。
B.公式M="m/V" Vm中,已知物质的体积和质量,如果不知气体摩尔体积,无法计算其摩尔质量,故B无法确定。
C.由公式M=m/n可知,质量和物质的量为已知,能计算其摩尔质量,故C不选。
D、单位物质的量的物质所具有的质量叫做摩尔质量,已知物质一个分子的实际质量,在数值上1mol该分子的质量等于其相对分子质量,故D不选。
故选B
考点:物质的量的计算
点评:本题考查了有关摩尔质量的公式,难度不大,能灵活运用公式是解本题的关键
本题难度:一般
3、计算题 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。请填空:
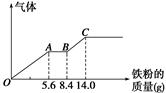
(1)AB段的反应的离子方程式为 ;
(2)原混合酸中NO3-物质的量浓度为 mol·L-1;
(3)原混合物中H2SO4物质的量为 mol。
参考答案:(1). Fe+2Fe3+=3Fe2+ (2).
本题解析:
试题分析:某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中的一份混合液中加入铜粉,铜被硝酸氧化为铜离子。由于n(Cu)=9.6g/64g·mol-1="0.15" mol根据离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知n(NO3-)=(3/2)n(Cu)=0.1mol.所以C(NO3-)=n/V=0.1mol/0.1L="1.0" mol/L.向另一份中逐渐加入铁粉,各个阶段发生的反应为:O→A:Fe+4H++NO3-=Fe3++NO↑+2H2O;A→B:Fe+2Fe3+=3Fe2+;B→。C:Fe+2H+=Fe2++H2↑发生第一个反应消耗氢离子的物质的量为n ( H+)=4n(NO3-)=0.4mol,发生第三个反应消耗的氢离子的物质的量为:n ( H+)="2n" (Fe)=2(14.0-8.4)g/56g.mol-1.="0.2" mol. n ( H+)总=0.4mol+0.2mol=0.6mol.因为n ( H+)总=2n(H2SO4)+n(HNO3),硝酸产生的氢离子和硝酸根离子相等,所以n(H2SO4)="n" ( H+)总-n(HNO3)={0.6mol-0.1mol}/2="0.25" mol.原来的混合溶液平均分成两份,每份含有硫酸0.25 mol,所以一共含硫酸的物质的量为0. 5 mol。
考点:考查硫酸、硝酸的混合液与变价金属发生在各个阶段的反应及实质的问题。
本题难度:困难
4、选择题 下列叙述中正确的是
A.硝酸的摩尔质量63g
B.1mol CO的体积约为22.4L
C.2g氢气所含原子数目为1mol
D.铁的摩尔质量在数值上等于铁原子的相对原子质量
参考答案:D
本题解析:
试题分析:A.摩尔质量的单位是g/mol,错误;B.没有条件,无法确定气体摩尔体积,错误;C.2g氢气的物质的量为1mol,氢气是双原子分子,所含原子数目为2mol,错误;D.铁的摩尔质量在数值上等于铁原子的相对原子质量,正确;选D。
考点:考查摩尔质量、相对原子质量的概念,物质的量的计算。
本题难度:一般
5、选择题 100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度约为[???? ]
A.0.20mol/L
B.0.25mol/L
C.0.4mol/L
D.0.5mol/L
参考答案:C
本题解析:
本题难度:简单