微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 同样条件下,将Mg、Al、Fe分别投入质量相等且足量的稀硫酸中,反应结束后,三种溶液质量仍相等,则投入的Mg、Al、Fe三种物质的质量关系正确的是
A.Mg>Al>Fe
B.Al>Fe>Mg
C.Al>Mg>Fe
D.Fe>Mg>Al
参考答案:C
本题解析:设所加入的三种金属Mg、Al、Fe的质量分别为m1、m2、m3,
Mg→H2↑???????? 2Al→3H2↑?????????? Fe→H2↑
24???? 2??????? 27×2?? 3×2????????? 56??? 2


本题难度:简单
2、选择题 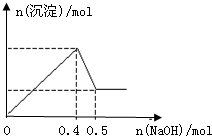 现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl-与SO42-的物质的量之比为
现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl-与SO42-的物质的量之比为
A.1:3
B.1:6
C.2:3
D.3:2
参考答案:C
本题解析:分析:由图可知加入0.4molNaOH,沉淀达最大量,沉淀为氢氧化镁、氢氧化铝,根据氢氧根守恒可知2n[Mg(OH)2]+3n[Al(OH)3]=n(OH-)=0.4mol,加入0.5molNaOH时,沉淀由最大值减小为最小值,故0.1molNaOH溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.1mol,计算出n[Mg(OH)2],根据化学式MgCl2可知溶液中n(Cl-)=2n[Mg(OH)2],根据化学式Al2(SO4)3可知溶液中n(SO42-)= n[Al(OH)3],据此计算判断.
n[Al(OH)3],据此计算判断.
解答:由图可知加入0.4molNaOH,沉淀达最大量,沉淀为氢氧化镁、氢氧化铝,根据氢氧根守恒可知2n[Mg(OH)2]+3n[Al(OH)3]=n(OH-)=0.4mol,加入0.5molNaOH时,沉淀由最大值减小为最小值,故0.1molNaOH溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.1mol,所以2n[Mg(OH)2]+3×0.1mol=0.4mol,故n[Mg(OH)2]=0.05mol,根据化学式MgCl2可知溶液中n(Cl-)=2n[Mg(OH)2]=2×0.05mol=0.1mol,根据化学式Al2(SO4)3可知溶液中n(SO42-)= n[Al(OH)3]=
n[Al(OH)3]= ×0.1mol=0.15mol,所以原溶液中Cl-与SO42-的物质的量之比为0.1mol:0.15mol=2:3.
×0.1mol=0.15mol,所以原溶液中Cl-与SO42-的物质的量之比为0.1mol:0.15mol=2:3.
故选:C.
点评:考查离子反应计算、化学反应图象计算等,难度中等,清楚图象中各阶段发生的反应是解题的关键.
本题难度:困难
3、选择题 将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应现象:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
参考答案:B
本题解析:试题分析:A、二者分别生成红棕色气体、无色气体,前者反应更剧烈,错误;B、Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+4H2O中1mol Cu消耗4mol HNO3,而3Cu+8HNO3(浓)==3Cu(NO3)2+2NO↑+4H2O中1mol Cu消耗8/3mol HNO3,故前者多、后者少,正确;C、前者生成红棕色气体,后者生成无色气体,故前者深、后者浅,错误;D、由于铜不足,则转移的电子总数应根据铜计算,由于铜质量相等,故二者应相等,错误。
考点:考查浓稀硝酸与铜的反应等相关知识。
本题难度:一般
4、选择题 下列有关金属元素特征的叙述正确的是(?????)。
A.金属元素的原子只有还原性,其阳离子只有氧化性
B.金属元素的单质在常温下都为固体
C.含金属元素的离子都是阳离子
D.金属阳离子被还原不一定得到金属单质
参考答案:D
本题解析:
试题分析:A不正确,金属阳离子也可以具有氧化性,例如亚铁离子;B不正确,例如金属汞是液态;C不正确,例如MnO4-、AlO2-等;D正确,铁离子被还原生成亚铁离子,答案选D。
考点:考查金属元素的有关判断
点评:该题可以通过举例逐一进行排除得到正确的结论。
本题难度:简单
5、选择题 为了检验溶液中是否含有Fe3+,可向溶液中加入
A.NaCl溶液
B.铁片
C.KSCN溶液
D.石蕊溶液
参考答案:C
本题解析:滴加KSCN溶液,溶液变为血红色,证明含Fe3+,这是检验Fe3+的特征反应
本题难度:困难