微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关电解质溶液关系正确的是
A.分别向pH=2的盐酸和醋酸溶液中,加水稀释到pH=4,消耗水的体积相等
B.等物质的量浓度的氯化钠和醋酸钠溶液中,微粒关系有c(Na+)= c(Cl-)+c(CH3COO-)
C.在NaHSO3溶液微粒由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
D.若弱酸的酸性H2A>H2B,则等物质的量浓度等体积的Na2A、Na2B溶液中,阴离子数目前者大于后者
参考答案:C
本题解析:
试题分析:选项A中盐酸为强酸,醋酸为弱酸,加水稀释时醋酸消耗水的体积大。选项B中油正负电荷守恒得c(Na+)+c(H+)= c(Cl-)+c(CH3COO-)。选项D中H2A酸性强于H2B,B2-离子与氢离子结合的能力强于A2-离子,因此Na2A的碱性弱于Na2B。再根据c(Na+)+c(H+)=c(A2-)+c(OH-) ,
c(Na+)+c(H+)=c(A2-)+c(OH-),Na+浓度相同,A中的c(H+)大于B中c(H+),可得Na2A溶液中的阴离子数多
点评:本题关键在于会
本题难度:简单
2、填空题 (1)某温度下纯水中的c(H+) = 2×10-7mol/L,则此时c(OH-) =________mol/L,该纯水的pH_______7(填“>”、“<”、“=”)。若温度不变,滴入稀硫酸使c(H+) = 5×10-6mol/L,则c(OH-) =________mol/L,由水电离出的c(H+) =________mol/L,
(2)已知在室温下,盐酸的pH=a,氢氧化钡的pH=b,且a+b=14,两者等体积混合后,溶液的pH=??????。
若酸碱按体积比为1:10混合后溶液显中性,则a+b=??????????。
参考答案:⑴、2×10-7(2分)?<(2分)? 8×10-9(2分)
本题解析:略
本题难度:简单
3、填空题 能源是影响全球经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是最理想的清洁能源之一。已知反应:2H2+O2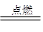 2H2O,试回答下列问题。
2H2O,试回答下列问题。
(1)该反应为 反应(填“吸热”或“放热”);
(2) 1当生成8g H2O时,H2O的物质的量是 (填字母代号)。
A.1mol B.1mol/L C.1g/mol
参考答案:(1)放热 (2)A
本题解析:(1)氢气燃烧是放热反应,所以该反应为放热反应。
(2) 1当生成8g H2O时,H2O的物质的量为1mol,故选A
本题难度:一般
4、选择题 一定温度下,某NaCl稀溶液中c(H+)为1×10-6 mol·L-1,下列说法正确的是(????)
A.该NaCl溶液显酸性
B.该NaCl溶液中Kw=1×10-14
C.该NaCl溶液稀释10倍后pH=7
D.该NaCl溶液中Kw=1×10-12
参考答案:D
本题解析:
试题分析:A. NaCl是强酸强碱盐。水溶液为中性。在室温下,中性溶液的pH=7,酸性溶液pH<7.但是该实验温度不清楚。因此在NaCl溶液中c(H+)为1×10-6 mol/L不是酸性溶液。错误。B.Kw= c(H+) ·c(OH-)= 1×10-12 mol2/L2.错误。C.该NaCl溶液是中性溶液,pH=6,再进行稀释,无论稀释多少倍,溶液仍然为中性,pH=6.错误。D.由B的计算可知Kw=1×10-12 。正确。
本题难度:一般
5、选择题 常温下,把1mL0.1mol/L的H2SO4加水稀释到2L溶液,在此溶液中由水电离产生的H+浓度接近于 (?? )
A.1.0×10-4mol/L
B.1.0×10-8mol/L
C.1.0×10-11mol/L
D.1.0×10-10mol/L
参考答案:D
本题解析:C(H+)==10-4mol;故水电离的为10-10mol/L
本题难度:简单