微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在50 mL FeCl3和CuCl2的混合溶液中,FeCl3和CuCl2的浓度均为1 mol/L,在混合溶液中加入100 mL NaOH溶液,恰好完全反应,则该NaOH溶液的浓度为(??)
A.0.5mol/L
B.1mol/L
C.1.25mol/L
D.2.5mol/L
参考答案:D
本题解析:略
本题难度:简单
2、选择题 NA代表阿伏加德罗常数,下列叙述错误的是(???)
A.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子
B.1 mol羟基中电子数为10NA
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氮原子数为0.2NA
参考答案:B
本题解析:
试题分析:B项:应为9NA,故错。故选B。
点评:本题考查了阿伏伽德罗常数的应用,题目难度不大,主要考查质量换算物质的量计算微粒数,氧化还原反应的电子转的电子数计算。
本题难度:一般
3、实验题 用氯化钠固体配制1.00mol/L的NaCl溶液95mL,回答下列问题
⑴所需仪器为:托盘天平、量筒、烧杯胶头滴管,若要完成实验,还需要两种玻璃仪器为??????、?????。
⑵该实验的实验步骤为:
①计算,②称量???????gNaCl, ③溶解,④移液,⑤洗涤,⑥定容,⑦ 摇匀。
⑶试分析下列操作,对所配溶液的浓度有何影响。(用偏低、偏高、无影响填空)。
①用天平称量氯化钠后,发现砝码底部有锈斑。所配溶液的浓度?????????????;
②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容。所配溶液的浓度????????????;
③容量瓶不干燥,含有少量蒸馏水。所配溶液的浓度??????????????;
④若定容时仰视刻度线。所配溶液的浓度??????????????;
⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度。则所配溶液的浓度??????。
参考答案:⑴100 mL容量瓶?玻璃棒???⑵5.9?⑶①偏高??偏高
本题解析:
试题分析:(1)由于实验室没有95ml容量瓶,所以要用氯化钠固体配制1.00mol/L的NaCl溶液95mL,则需要100ml容量瓶,另外还缺少溶解和转移时的玻璃棒。
(2)需要氯化钠的质量=0.1L×1.00mol/L×58.5g/mol=5.85g≈5.9g。
(3)根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,
本题难度:一般
4、选择题 V mL Fe2(SO4)3溶液中含Fe3+m mg,则溶液中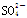 的物质的量浓度为
的物质的量浓度为
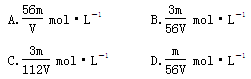
参考答案:C
本题解析:
试题解析:Wg Fe3+的物质的量为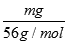 =
=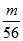 mol,所以n(SO42-)=
mol,所以n(SO42-)= n(Fe3+)=
n(Fe3+)= ×
×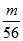 mol=
mol=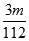 mol,SO42-的物质的量浓度为
mol,SO42-的物质的量浓度为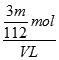 =
= 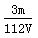 mol·L-1,故选C.
mol·L-1,故选C.
考点:物质的量浓度的有关计算
本题难度:一般
5、选择题 下列溶液中Cl-的物质的量浓度最大的是
A.300 mL 3.5 mol/L KCl溶液
B.1000 mL 2.5 mol/L NaCl溶液
C.250 mL1 mol/L AlCl3溶液
D.200 mL 2 mol/L MgCl2溶液
参考答案:D
本题解析:
试题分析:A、3.5 mol/L KCl溶液中Cl-的物质的量浓度为3.5 mol/L;B、2.5 mol/L NaCl溶液中Cl-的物质的量浓度为2.5 mol/L;C、1 mol/L AlCl3溶液中Cl-的物质的量浓度为3 mol/L;D、2 mol/L MgCl2溶液中Cl-的物质的量浓度为4 mol/L。最大的为D,答案选D。
考点:考查物质的量浓度的计算。
本题难度:一般