微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用水稀释0.1mol/L的CH3COOH溶液,其中随水的量增大的有
(1)n(H+) (2)c(H+) (3)c(H+)/c(CH3COOH) (4)c(CH3COOH)/ c(H+)
A.(1)(3)
B.(1)(4)
C.(3)(4)
D.(1)(2)
参考答案:A
本题解析:
试题分析:CH3COOH溶液中存在CH3COOH CH3COO—+ H+,用水稀释0.1mol/L的CH3COOH溶液,其中随水的量增大电离平衡正向移动,n(H+)增大但c(H+)、c(CH3COOH)、c(CH3COO—)均减小,c(OH—)增大,且c(CH3COOH)的减小程度大于c(H+)、c(CH3COO—)的减小程度,故c(H+)/c(CH3COOH)增大,c(CH3COOH)/ c(H+)减小,A项正确。
CH3COO—+ H+,用水稀释0.1mol/L的CH3COOH溶液,其中随水的量增大电离平衡正向移动,n(H+)增大但c(H+)、c(CH3COOH)、c(CH3COO—)均减小,c(OH—)增大,且c(CH3COOH)的减小程度大于c(H+)、c(CH3COO—)的减小程度,故c(H+)/c(CH3COOH)增大,c(CH3COOH)/ c(H+)减小,A项正确。
考点:电离平衡移动。
本题难度:一般
2、选择题 为了增大氯水中的HClO浓度,应采取的措施是
A.加入NaOH固体
B.加入食盐固体
C.加入CaCO3固体
D.加入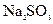 固体
固体
参考答案:C
本题解析:略
本题难度:一般
3、填空题 (4分)化学上常用电离度表示电解质的相对强弱:α=已电离的电解质分子数/溶液中原有电解质的总分子数×100%。
物质(微粒)及编号
| 电离度α
|
A.硫酸溶液(第一步完全电离):
HSO H++SO H++SO
| 10%
|
B.硫酸氢钠溶液:HSO H++SO H++SO
| 29%
|
CH3 COOH COOH CH3COO-+H+ CH3COO-+H+
| 1.33%
|
D.盐酸:HCl=H++Cl-
| 100%
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是_____(填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO的电离度小于相同温度下0.1 mol·L-1硫酸氢钠溶液中HSO的电离度,其原因是__________________。
参考答案:
 本题解析:略 本题解析:略
本题难度:简单
4、选择题 常温下0.1mol?L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列正确是( )
A.该溶液中由水电离出的c(H+)=1×10-11mol?L-1
B.浓度均为0.1mol?L-1的HA和NaA溶液等体积混合后,若溶液呈酸性,则有:c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
C.0.1mol?L-1HA溶液与0.05mol?L-1NaOH溶液等体积混合后所得溶液中:c(A-)+c(HA)=c(Na+)
D.0.1mol?L-1HA溶液与0.05mol?L-1NaOH溶液等体积混合后所得溶液中:c(H+)+c(HA)=c(OH-)
参考答案:A、根据c(O
本题解析:
本题难度:简单
5、选择题 将H+浓度相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸)分别与锌反应,若最后有一溶液中有锌剩余,且放出的气体一样多,对此有如下判断:
(1)反应所需时间乙<甲(2)开始时反应速率甲>乙(3)参加反应的锌的质量甲=乙(4)整个反应阶段的平均速率乙>甲(5)盛盐酸的容器中有锌剩余(6)盛醋酸的容器中有锌剩余
以上判断正确的是(??? )
A.(1)(2)(3)(5)
B.(1)(3)(5)
C.(2)(3)(6)
D.(1)(3)(4)(5)
参考答案:D
本题解析:盐酸是强酸,醋酸是弱酸,当两者H+浓度相同时,醋酸浓度比盐酸浓度大得多。依题意与锌反应放出的氢气一样多,则参加反应的锌以及参加反应的酸一样多,故盐酸反应完,醋酸有剩余。盐酸中有锌剩余。由于两者H+浓度相同所以开始反应速率相等,但由于醋酸存在电离平衡,当H+浓度减小时平衡右移补充H+浓度,故反应较快。
本题难度:简单
|