微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)【化学——化学与技术】
合成氨工业对国民经济和社会发展具有重要意义,下图是工业合成氨的简要流程示意图。
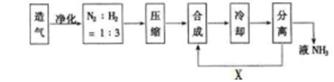
(1)合成氨的原料气往往混有CO2等杂质,在进入合成塔之前需净化,其原因是_______ 。
(2)工业上合成氨选择的适宜条件是:以铁为主的催化剂、_______、________。
(3)沿X路线进入合成塔的物质是_______,这样设计的意义是________。
(4)目前工业制硝酸所采用的主要方法是_______法。
参考答案:(12分)
(1)防止杂质使合成氨所用的催化剂“中毒”
本题解析:
试题分析:(1)原料气往往混有CO、NH3等杂质,在进入合成塔之前为防止催化剂中毒,需进行净化。
(2)选择400℃~500℃,反应速率和平衡转化率都较高,如温度过高,转化率反而降低,常压下,平衡转化率较高,如增大压强,会造成设备造价和耗能增加,故答案为:400~500℃;10~30Mpa。
(3)合成氨工业中,利用氨易液化,分离出N2、H2循环使用,可使平衡向正反应方向移动,则氨气的产率增大;未反应的氮气和氢气循环进入合成塔,使氮气和氢气得到充分利用,提高了原料的利用率。
(4
本题难度:一般
2、选择题 化学与工农业生产和人类生活密切相关。下列说法中,不正确的是:
A.使用太阳能等代替化石燃料,符合低碳节能减排的要求
B.油脂在碱性条件下水解可制得肥皂
C.海轮外壳上镶入锌块,可减缓船体的腐蚀
D.二氧化硫的大量排放是造成光化学烟雾的主要原因
参考答案:D
本题解析:二氧化硫的大量排放会造成酸雨,光化学烟雾是氮的氧化物造成的,D错误;所以答案选D。
本题难度:一般
3、实验题 (15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下:

回答下列问题:
 ??(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:???????????????。
??(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:???????????????。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
?????????(填写仪器名称)。
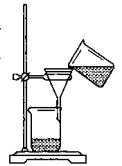
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处:?????????????????????;
②过滤后,洗涤过滤器中少量沉淀的方法是?????????????。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2
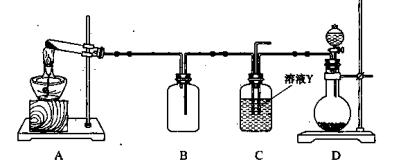
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl??? b.CaCO3(块状)?? c.Ca(OH)2????d.NaOH
e.浓氨水??? f.稀盐酸???? g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为????和?????(用药品序号填空);装置D处药品的最佳选择为??????和?????(用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是???????(填序号)。
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式???????????????????。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是???????????????????;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为?????。(离子的浓度用符号[NH+4]和[SO2-4]表示)
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
4、实验题 由黄铜矿为原料(主要成分为CuFeS2)制备99.95%~99.98%精铜的流程如下:
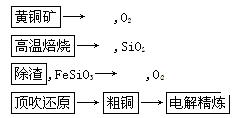
(1) 高温焙烧第一反应为2CuFeS2+4O2===Cu2S+2FeO+3SO2,该反应中氧化剂为____________。产物Cu2S在1 200℃高温下继续反应:2Cu2S+3O2===2Cu2O+2SO2,2Cu2O+Cu2S===6Cu+SO2。6mol CuFeS2和14.25mol O2反应,理论上可得到Cu________mol(假定各步反应都完全)。
(2) 取三份质量均为16.9g的上述粗铜,成分为Cu、Fe、Zn。现在需要分析其中铜的含量,进行如下实验(所有气体体积均为标况下的数据):
① 取一份粗铜放入足量稀硫酸中,共放出氢气1.568L。
② 另取一份粗铜放入稍过量的较浓硝酸中,加热使合金铜完全溶解,收集 到了NO和NO2的混合气体8.736L,与3.304LO2混合后,得到的混合气体恰好被水完全吸收。
到了NO和NO2的混合气体8.736L,与3.304LO2混合后,得到的混合气体恰好被水完全吸收。
③ 再取一份粗铜进行电解精炼,阳极完全溶解后阴极增加质量17.28g。
求粗铜中Cu的质量分数(保留一位小数)。
参考答案:(1) CuFeS2、O2(各1分) 4.5(4分)
本题解析:略
本题难度:一般
5、选择题 工业上冶炼金属的方法正确的是
A.采用加热分解法冶炼金属钾
B.采用电解法冶炼金属铝和钠
C.采用热还原法冶炼金属铁与汞
D.采用热还原法冶炼金属铜与钙
参考答案:B
本题解析:
正确答案:B
A.不正确,钾是活泼金属,采用电解法冶炼金属钾;B.正确,采用电解法冶炼金属铝和钠,它们是活泼金属; C.不正确,采用热还原法冶炼金属铁与采用加热分解法冶炼金属汞; D.不正确,采用热还原法冶炼金属铜与采用电解法冶炼金属钙。
本题难度:一般