微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
(1)请回答下列电极的名称:B(石墨)电极的名称是______.
(2)写出电极反应式:
通入O2的电极的电极反应式是______.
A(Fe)电极的电极反应式为______,
(3)乙池中反应的化学方程式为______.
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2______mL(标准状况下)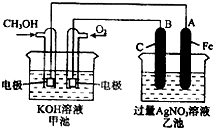
参考答案:(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学
本题解析:
本题难度:一般
2、选择题 下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用银片做阳极,铁片作阴极,电解硝酸银溶液,铁片表面出现一层银
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
参考答案:A.铜为正极,正极上氢离子得电子被还原生成氢气,则铜片表面出
本题解析:
本题难度:一般
3、填空题 ( 12分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
参考答案:(1)1:1
(2)As2S3
本题解析:
试题分析:(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,As的化合价降低1价,As2S3整体降低2价,Sn的化合价升高2价,根据化合价升降总数相等,As2S3和SnCl2的物质的量之比为1:1;
(2)氧化剂中元素化合价降低,所以As2S3作氧化剂;硫化氢与氢氧化钠溶液反应生成硫化钠和水,也与硫酸铜溶液反应生成硫化铜和硫酸,所以产生的硫化氢气体可用氢氧化钠溶液或硫酸铜溶液吸收;
(3)生成2mol H3AsO4时有10mol的二氧化氮生成,该反应中只有硝酸根离子被还原,所以转移的电子的物质的量是10mol;
(4)11.2L的氧气的物质的量是0.5mol,生成的硝酸的物质的量是2mol,则浓硝酸与C反应生成的二氧化碳的物质的量理论上是0.5mol,但二氧化碳溶于水,所以最终产生的二氧化碳的物质的量小于0.5mol,答案选a。
考点:考查对氧化还原反应的分析、计算
本题难度:一般
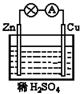
4、选择题 在如图所示的原电池中,下列说法正确的是( )
A.负极发生还原反应
B.正极反应为?Cu-2e-Cu2+
C.电子由锌片通过导线流向铜片
D.该装置能将电能转化为化学能
参考答案:A.该原电池中,负极是锌,放电时,锌失电子发生氧化反应,故A
本题解析:
本题难度:简单
5、选择题 将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是( )
A.溶液的PH增大
B.溶液中的Zn2+浓度增大
C.溶液中的SO42-浓度增大
D.溶液的密度增大
参考答案:A、原电池放电时,正极上氢离子得电子生成氢气析出,导致溶液中
本题解析:
本题难度:简单