微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 F2和Xe在一定条件下可生成XeF2、XeF4和?XeF6三种氟化氙,它们都是极强的氧化剂,下列关于Xe的氟化物的叙述不正确的是( )
A.XeF2分子中Xe原子最外层不是八电子结构
B.XeF2、XeF4和XeF6的固态均是分子晶体
C.熔点大小顺序XeF2<XeF4<XeF6
D.Xe元素的所在族的原子的外围电子排布式均为ns2np6,属于非金属元素
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列表达式错误的是[???? ]
A.甲烷的电子式 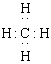
B.氟化钠的电子式 
C.硫离子的核外电子排布式 1s22s22p63s23p4
D.碳-12原子 
参考答案:C
本题解析:
本题难度:简单
3、选择题 主族元素原子失去最外层电子形成阳离子,主族元素的原子得到电子填充在最外层形成阴离子.下列各原子或离子的电子排布式错误的是( )
A.Ca2+:1s22s22p63s23p6
B.Ar:1s22s22p63s23p6
C.Cl-:1s22s22p63s23p6
D.O2-:1s22s22p4
参考答案:A、钙原子失去2个电子变成钙离子,使次外层变成最外层,所以钙
本题解析:
本题难度:一般
4、选择题 下列各选项中分子中各原子均达到8电子稳定结构的是( )
A.SiO2
B.SiCl4
C.P2O5
D.SO2
参考答案:B
本题解析:
本题难度:简单
5、填空题 铜单质及其化合物在很多领域有重要的用途.如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和CuCl2都是重要的化工原料,常用作颜料、防腐剂和消毒剂等.
Ⅰ.超细铜粉的某制备方法如图1:
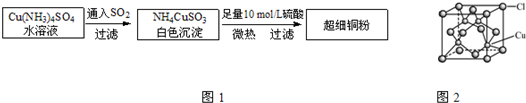
(1)N、O、S三种元素的第一电离能由大到小顺序为______.
(2)化合物NH4CuSO3中,金属阳离子的核外电子排布式为______.
(3)化合物Cu(NH3)4SO4中,N原子的杂化方式为______,SO42-的空间构型为______.
Ⅱ.氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
(4)写出上述制备CuCl的离子方程式______.
(5)CuCl的晶胞结构如图2所示,其中Cl原子的配位数为______.
(6)CuCl的熔点比CuO的熔点______(选填“高”或“低”).
参考答案:Ⅰ(1)同一周期元素的第一电离能随着原子序数的增大呈增大趋势
本题解析:
本题难度:一般