微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列各溶液中,离子一定能大量共存的是:
A.pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.无色溶液中:K+、Na+、MnO4-、SO42-
D.室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
参考答案:A
本题解析:
试题分析:A.pH=11的溶液是碱性溶液,在碱性溶液中CO32-、Na+、AlO2-、NO3-不会发生任何反应,可以大量共存,正确;B. Fe3+、I-会发生氧化还原反应,不可以大量共存,错误;C.在无色溶液中紫色离子MnO4-不可以大量共存,错误;D.室温下,pH=1的溶液是酸性溶液,此时H+、Fe2+、NO3-会发生氧化还原反应,不可以大量共存,错误。
考点:考查离子电离共存的知识。
本题难度:一般
2、选择题 一定能在下列溶液中大量共存的离子组是[???? ]
A.含有大量Fe2+的溶液:S2-、 Na+、NH4+、ClO-、SO42-
B.由水电离的c(OH-)=l×10-13mol·L-1的溶液:Na+、Ca2+、Mg2+、Ba2+
C.含有大量AlO2-的溶液:Na+、K+、NO3-、CO32-
D.含有大量NO3-的溶液:H+、C2O42-、SO42-、Cl-
参考答案:C
本题解析:
本题难度:一般
3、填空题 (10分)某强酸性溶液X含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO 、SO
、SO 、SO
、SO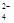 、Cl-、NO
、Cl-、NO 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
参考答案:(1)Fe2+、SO42-、NH4+、Al3+;
(2
本题解析:
试题分析:由题干知该溶液为强酸性溶液所以CO32-、SO32-一定不存在;由流程图中信息可知:加过量Ba(NO3)2生成气体A为NO,气体D为NO2,溶液E为HNO3溶液,可判定原溶液一定有Fe2+,一定无NO3-;由此可推断沉淀G为Fe(OH)3;加过量Ba(NO3)2生成沉淀C为BaSO4,则原溶液中一定有SO42-无Ba2+;
加过量NaOH溶液生成气体F为NH3,则溶液中一定有NH4+;通入过量CO2时生成沉淀I为Al(OH)3,则原溶液中一定有Al3+,若NO、NH3、Al(OH)3均为0.01 mol、BaSO4为0.07 mol,综合上述分析可知10 mL X溶液中Fe2+、NH4+、Al3+、SO42-的物质的量各为0.03mol、0.01mol、0.01mol、0.07 mol;又知10 mL X溶液中n(H+)=0.04 mol,恰好符合电荷守恒因此如果可以测定原溶液中还有Fe3+则有Cl-,否则没有Cl-.
考点:了解离子反应的概念、离子反应发生的条件。了解常见离子的检验方法。
点评:熟练掌握离子的性质进行离子检验,同时也要注意离子间的量的关系如第(3)题中应用电解质溶液中的电荷守恒关系。
本题难度:困难
4、选择题 下列强酸性溶液中,能大量共存的是
A.Ca2+、K+、HCO3-、OH-
B.Fe2+、Cl-、H+、MnO4-
C.Fe2+、Mg2+、Cl-、NO3-
D.K+、NH4+、SO42-、Cl-
参考答案:D
本题解析:
试题解析: 在酸性条件下HCO3-、OH-不共存,故A错误;在酸性条件下Fe2+、H+、MnO4-发生氧化还原反应,故B错误;在酸性条件下Fe2+、NO3-发生氧化还原反应,故C错误;在酸性条件下可以大量共存,故D正确。
考点: 离子共存
本题难度:一般
5、选择题 下列离子在水溶液中,无色且能大量共存的是
A.Fe3+ 、K+、NO3- 、Cl-
B.Ba2+ 、K+、Cl- 、OH-
C.H+、Mg2+ 、HCO3- 、SO42-
D.Na+、K+、MnO4- 、NO3-
参考答案:B
本题解析:
试题解析:Fe3+ 有颜色,故A错误;离子都为无色,且不发生离子反应,故B正确;H+与HCO3-发生反应,不能共存,故C错误;MnO4-有颜色,故D错误。
考点:离子共存
本题难度:一般